FRAP
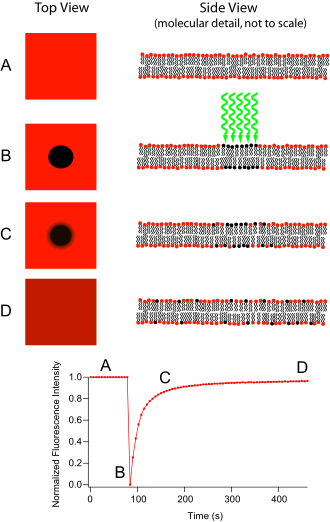
Il FRAP (Fluorescence recovery after photobleaching) è una tecnica ottica capace di quantificare la diffusione laterale bidimensionale di un sottile film molecolare, o di una membrana cellulare, che contenga sonde fluorescenti. Questa tecnica è molto utile negli studi biologici sulla diffusione ed il legame proteico nelle membrane cellulari. Inoltre, la deposizione di uno strato fosfolipidico fluorescente permette la caratterizzazione dell'idrofilia (o idrofobia) della superficie in termini di struttura della superficie stessa ed energia libera.
Apparato sperimentale[modifica | modifica wikitesto]
L'apparato base è costituito da un microscopio ottico, una fonte luminosa e delle sonde fluorescenti. La fluorescenza è subordinata all'assorbimento di una specifica lunghezza d'onda (il "colore" della luce), fattore che limita la scelta di lampade. In genere viene usata una fonte di luce ad ampio spettro a mercurio o xeno con un monocromatore. La procedura inizia salvando l'immagine di sfondo della membrana oggetto di studio prima del bleaching, quindi la fonte di luce è puntata su una piccola porzione dello spazio visibile (utilizzando un raggio laser di lunghezza d'onda idonea o aumentando l'ingrandimento del microscopio). I gruppi fluorofori in questa regione ricevono un'elevata intensità di luce che ne fa svanire rapidamente la fluorescenza (la quale dura circa 105 fotoni prima dell'estinzione). Ora l'immagine al microscopio è quella di un campo uniformemente fluorescente con un punto scuro. In seguito ai moti Browniani i fosfolipidi fluorescenti diffondono nella regione scura sostituendo le sonde non più fluorescenti. Questa diffusione procede in modo "ordinato" e analiticamente determinabile secondo l'equazione di diffusione. Assumendo un profilo Gaussiano da parte del raggio di bleaching si ha che la costante di diffusione D può essere calcolata da:
dove w è il raggio del fascio di luce e tD il tempo di diffusione "caratteristico".[1][2]
Applicazioni[modifica | modifica wikitesto]
La tecnica FRAP è stata inizialmente sviluppata per osservare la diffusione laterale di molecole fluorescenti all'interno di superfici bidimensionali. La prima applicazione fu l'osservazione della diffusione di proteine di membrana marcate con un fluoroforo all'interno di una membrana cellulare al fine di determinarne il tipo di movimento e il coefficiente di motilità [1]. La FRAP è utilizzata anche per effettuare studi di dinamica tra recettore e ligando tramite la misura del coefficiente di diffusione di quest'ultimo. Lo sviluppo della microscopia confocale ha permesso di estendere le applicazioni della FRAP alle tre dimensioni, consentendo lo studio delle dinamiche molecolari non solo all'interno delle membrane ma anche nel citoplasma, nel nucleo o in altre strutture cellulari [3]. Si possono studiare i movimenti di determinate proteine sintetizzandole in fusione con la green fluorescent protein (GFP) e osservandone la diffusione e il movimento dopo la procedura di bleaching. L'osservazione del ripristino della fluorescenza in aree sottoposte a bleaching permette di ottenere informazioni sui partner di interazione di proteine, traffico di proteine e continuità degli spazi. Il sistema permette di distinguere tra fenomeni di diffusione spontanea e flussi in determinate direzioni: i movimenti direzionati, notati già nelle prime osservazioni, possono essere dovuti ad un flusso netto del citoplasma o a meccanismi di trasporto lungo i microtubuli del citoscheletro mediato da motori molecolari.
Note[modifica | modifica wikitesto]
- ^ a b D. Axelrod, D.E. Koppel, J. Schlessinger, E. Elson, W.W. Webb, Mobility measurement by analysis of fluorescence photobleaching recovery kinetics, in Biophysical Journal, vol. 16, n. 9, 1976, pp. 1055–1069, DOI:10.1016/S0006-3495(76)85755-4.
- ^ Brian L. Sprague, Robert L. Pego, Diana A. Stavreva, James G. McNally, Analysis of Binding Reactions by Fluorescence Recovery after Photobleaching, in Biophysical Journal, vol. 86, n. 6, 2004, pp. 3473–3495, DOI:10.1529/biophysj.103.026765.
- ^ K. Tripathi, W.K. Parnaik, Differential dynamics of splicing factor SC35 during the cell cycle, in Journal of biosciences, vol. 33, n. 3, 2008, pp. 345–54, DOI:10.1007/s12038-008-0054-3, PMID 19005234.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su FRAP
Wikimedia Commons contiene immagini o altri file su FRAP
