Pirazina: differenze tra le versioni
gruppo di simmetria; aggiustata lingua italiana |
Aggiunte notizie chimiche, biologiche e sulla sintesi della molecola; il tutto corredato da fonti |
||
| Riga 29: | Riga 29: | ||
|consigliP={{ConsigliP|210|261|305+351+338}}<ref>Sigma Aldrich; rev. del 05.10.2012</ref> |
|consigliP={{ConsigliP|210|261|305+351+338}}<ref>Sigma Aldrich; rev. del 05.10.2012</ref> |
||
}} |
}} |
||
La '''pirazina''' è un composto organico [[Composti aromatici|aromatico]] [[Composto eterociclico|eterociclico]]; il gruppo di simmetria |
La '''pirazina''' è un composto organico [[Composti aromatici|aromatico]] [[Composto eterociclico|eterociclico]] dall'odore pungente e dolciastro; la molecola presenta una [[Base_(chimica)|basicità]] inferiore rispetto a quelle di [[piridina]] e [[pirimidina]] <ref>{{cita web |titolo=Pyrazine {{!}} C4H4N2 {{!}} ChemSpider |url=https://www.chemspider.com/Chemical-Structure.8904.html?rid=e2532a2c-d5cb-457e-884b-ca9e4c8bd96b |website=www.chemspider.com }}</ref> ed il suo il [[Simmetria_molecolare|gruppo di simmetria]] è D<sub>2h</sub>. |
||
Può formarsi in alcune reazioni comprendenti sia la presenza di un amminoacido libero che composti derivanti dalla degradazione (ad opera di alte temperature ad esempio) dei monosaccaridi come ad esempio i deossiosoni; in questo caso denominata reazione di Strecker in cui, prima di arrivare alla formazione di pirazine si passa per intermedi come gli amminochetoni. |
|||
==Biologia e gastronomia== |
|||
La formazione di pirazina o di suoi derivati durante processi di cottura in matrici alimentari, costituite sia da una frazione zuccherina che da una frazione proteica/amminoacidica, caratterizza le tipiche note di tostato che si percepiscono in alcuni alimenti. |
|||
La pirazina è uno dei [[feromone|feromoni]] usati dalle [[formicidae|formiche]] per tracciare i propri percorsi <ref>https://www.sciencealert.com/leafcutter-ants-microbiome-may-produce-communication-chemical-pyrazine</ref>. |
|||
La pirazina ed alcuni suoi derivati risultano responsabili dell'aroma di tostatura dei cibi <ref>{{cite journal |last1=Zhao |first1=Chao |last2=Cao |first2=Hui |last3=Xiao |first3=Jianbo |title=Pyrazines in Food |journal=Handbook of Dietary Phytochemicals |date=2020 |pages=1–25 |doi=10.1007/978-981-13-1745-3_44-1 |publisher=Springer |isbn=978-981-13-1745-3 |language=en|doi-access=free }}</ref>; tale famiglia di composti si forma infatti dalla degradazione termica di determinati monosaccaridi in presenza di amminoacidi liberi. |
|||
==Sintesi== |
|||
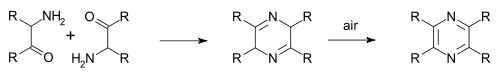
La pirazina può essere sintetizzata attraverso la '''reazione di Staedel–Rugheimer''', elaborata nel 1876: il 2-cloroacetofenone ragisce con [[ammoniaca]] generando un'alfa-chetoammina, che successivamente condensa e viene ossidata a pirazina<ref>''Ueber die Einwirkung von Ammoniak auf Chloracetylbenzol'' (pp. 563–564) W. Staedel, L. Rügheimer {{doi|10.1002/cber.187600901174}} Berichte der Deutschen chemischen Gesellschaft Volume 9, Issue 1, pp. 563–564, 1876</ref>. |
|||
Una variazione di poco posteriore è la '''sintesi di Gutknecht''', elaborata nel 1879, anch'essa basata sulla autocondensazione di un'alfa-chetoammina<ref>''Mittheilungen Ueber Nitrosoäthylmethylketon'' H. Gutknecht Berichte der Deutschen chemischen Gesellschaft Volume 12, Issue 2 , pp. 2290–2292, 1879 {{doi|10.1002/cber.187901202284}}</ref><ref>''Heterocyclic chemistry'' T.L. Gilchrist {{ISBN|0-582-01421-2}}</ref>. |
|||
:[[File:Gutknecht Pyrazine Synthesis.svg|500px|Gutknecht pyrazine synthesis]] |
|||
La '''sintesi di Gastaldi''' del 1921 è una variazione dello stesso concetto<ref>G. Gastaldi, Gazz. Chim. Ital. 51, ('''1921''') 233</ref><ref>''Amines: Synthesis, Properties and Applications'' Stephen A. Lawrence 2004 Cambridge University Press {{ISBN|0-521-78284-8}}</ref>. |
|||
:[[File:GastaldiSynthesis.svg|400px|Gastaldi synthesis]] |
|||
== Note == |
== Note == |
||
Versione delle 14:05, 26 mag 2023
| Pirazina | |
|---|---|
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H4N2 |
| Massa molecolare (u) | 80,09 |
| Aspetto | bianco cristallino |
| Numero CAS | |
| Numero EINECS | 206-027-6 |
| PubChem | 9261 |
| SMILES | C1=CN=CC=N1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,031 |
| Costante di dissociazione acida (pKa) a 300 K | 0,7 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 228 - 315 - 319 - 335 |
| Consigli P | 210 - 261 - 305+351+338 [1] |
La pirazina è un composto organico aromatico eterociclico dall'odore pungente e dolciastro; la molecola presenta una basicità inferiore rispetto a quelle di piridina e pirimidina [2] ed il suo il gruppo di simmetria è D2h.
Biologia e gastronomia
La pirazina è uno dei feromoni usati dalle formiche per tracciare i propri percorsi [3].
La pirazina ed alcuni suoi derivati risultano responsabili dell'aroma di tostatura dei cibi [4]; tale famiglia di composti si forma infatti dalla degradazione termica di determinati monosaccaridi in presenza di amminoacidi liberi.
Sintesi
La pirazina può essere sintetizzata attraverso la reazione di Staedel–Rugheimer, elaborata nel 1876: il 2-cloroacetofenone ragisce con ammoniaca generando un'alfa-chetoammina, che successivamente condensa e viene ossidata a pirazina[5]. Una variazione di poco posteriore è la sintesi di Gutknecht, elaborata nel 1879, anch'essa basata sulla autocondensazione di un'alfa-chetoammina[6][7].
La sintesi di Gastaldi del 1921 è una variazione dello stesso concetto[8][9].
Note
- ^ Sigma Aldrich; rev. del 05.10.2012
- ^ Pyrazine | C4H4N2 | ChemSpider, su chemspider.com.
- ^ https://www.sciencealert.com/leafcutter-ants-microbiome-may-produce-communication-chemical-pyrazine
- ^ (EN) Pyrazines in Food, in Handbook of Dietary Phytochemicals, Springer, 2020, pp. 1–25, DOI:10.1007/978-981-13-1745-3_44-1.
- ^ Ueber die Einwirkung von Ammoniak auf Chloracetylbenzol (pp. 563–564) W. Staedel, L. Rügheimer DOI: 10.1002/cber.187600901174 Berichte der Deutschen chemischen Gesellschaft Volume 9, Issue 1, pp. 563–564, 1876
- ^ Mittheilungen Ueber Nitrosoäthylmethylketon H. Gutknecht Berichte der Deutschen chemischen Gesellschaft Volume 12, Issue 2 , pp. 2290–2292, 1879 DOI: 10.1002/cber.187901202284
- ^ Heterocyclic chemistry T.L. Gilchrist ISBN 0-582-01421-2
- ^ G. Gastaldi, Gazz. Chim. Ital. 51, (1921) 233
- ^ Amines: Synthesis, Properties and Applications Stephen A. Lawrence 2004 Cambridge University Press ISBN 0-521-78284-8
Altri progetti
 Wikimedia Commons contiene immagini o altri file su Pirazina
Wikimedia Commons contiene immagini o altri file su Pirazina
Collegamenti esterni
- (EN) pyrazine, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | LCCN (EN) sh2007003956 · GND (DE) 4126456-3 · J9U (EN, HE) 987007559244005171 · NDL (EN, JA) 00575323 |
|---|