Solfuro di zinco
| Solfuro di zinco | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| solfuro di zinco | |
| Caratteristiche generali | |
| Formula bruta o molecolare | ZnS |
| Massa molecolare (u) | 97,43 g/mol |
| Aspetto | solido bianco inodore |
| Numero CAS | |
| Numero EINECS | 215-251-3 |
| PubChem | 14821 |
| SMILES | S=[Zn] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 4,01 (20 °C) |
| Solubilità in acqua | (20 °C) quasi insolubile |
| Temperatura di fusione | 1185 °C (sublima) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | –204,6 |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | >2000 (oral rat)[1] |
| Indicazioni di sicurezza | |
| Frasi H | --[2][1] |
Il solfuro di zinco è il composto inorganico con formula ZnS. È presente in natura principalmente nel minerale sfalerite, oppure nella forma più rara di wurtzite. La sfalerite costituisce la principale fonte industriale di zinco metallico. I minerali sono in genere neri per la presenza di varie impurezze, ma ZnS puro è un solido bianco inodore. ZnS è usato principalmente come pigmento, ma trova applicazione anche come materiale luminescente per fosfori, come semiconduttore e per materiali ottici.
Storia[modifica | modifica wikitesto]
La fosforescenza del solfuro di zinco fu documentata per la prima volta nel 1866 dal chimico francese Théodore Sidot.[3] ZnS fu usato da Ernest Rutherford ed altri nei primi anni della fisica nucleare come detector di scintillazione, perché emette luce se eccitato da raggi X o fasci di elettroni, diventando utile per schermi a raggi x e tubi catodici.[4]
Struttura[modifica | modifica wikitesto]


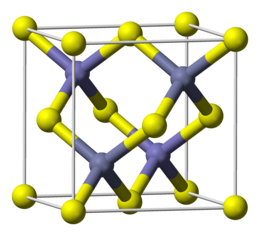
ZnS esiste in due forme cristalline principali, che costituiscono un esempio tipico di polimorfismo. Queste due strutture cristalline sono importanti, dato che si osservano anche in molti altri composti di formula generale AB, e sono comunemente designate con il nome dei minerali in cui ricorrono, cioè la blenda di zinco (o sfalerite) e la wurtzite. In entrambe le strutture sia lo zinco che lo zolfo sono tetracoordinati; la differenza di struttura nasce da un diverso impacchettamento degli atomi.[4]
La forma più comune, stabile a temperatura ordinaria, è quella tipo blenda di zinco, che può essere descritta come un impacchettamento cubico compatto di anioni solfuro, con gli ioni Zn2+ che occupano metà dei siti tetraedrici. La costante di reticolo è a = 540,93 pm.[5] Questo reticolo cristallino è analogo a quello del diamante, che si ottiene scambiando tutti gli atomi Zn e S con atomi di carbonio.[4]
La struttura tipo wurtzite diventa più stabile di quella blenda di zinco al di sopra di circa 1020 °C, ma il minerale wurtzite è comunque presente in natura dato che la velocità di interconversione tra le due diverse strutture è lentissima nella scala dei tempi geologici.[6] Nella wurtzite l'impacchettamento degli anioni solfuro è esagonale compatto, con gli ioni Zn2+ che occupano metà dei siti tetraedrici. Le costanti di reticolo sono a = 381,1 e c = 623,4 pm.[5]
Sintesi[modifica | modifica wikitesto]
Il solfuro di zinco è in genere ottenuto da depositi naturali o ricavato da materiali di scarto provenienti da altri processi come fonderie, scorie e salamoie.[7] È anche un sottoprodotto della sintesi di ammoniaca a partire da metano, dato che si utilizza ossido di zinco per catturare le impurità di solfuro di idrogeno presenti nel gas naturale:
In laboratorio si può produrre accendendo una miscela di zinco e zolfo, oppure trattando una soluzione di un sale solubile di zinco con una fonte di ioni solfuro come il solfuro di idrogeno. Questa reazione è alla base dell'analisi gravimetrica dello zinco:[8]
Applicazioni[modifica | modifica wikitesto]
Come pigmento[modifica | modifica wikitesto]
L'applicazione più importante del solfuro di zinco è come pigmento. In associazione con solfato di bario forma un pigmento bianco chiamato litopone, molto usato nelle vernici per interni.[7]
Come materiale luminescente[modifica | modifica wikitesto]
Il solfuro di zinco, con l'aggiunta di alcune ppm di attivatore, è usato come fosforo in varie applicazioni, come tubi catodici, schermi a raggi x e prodotti fosforescenti.[4] Usando argento come attivatore si ottiene un colore blu chiaro, con massimo di emissione a 450 nm. Con il manganese si ha un colore giallo-arancio, a circa 590 nm. Il rame permette una luminescenza verdastra di lunga durata, tipica degli oggetti fosforescenti commerciali. Il solfuro di zinco drogato con rame (ZnS: Cu) è usato anche in pannelli elettroluminescenti.[9]
Come materiale ottico[modifica | modifica wikitesto]
Il solfuro di zinco è usato come materiale ottico per la regione dell'infrarosso, dato che è trasparente a radiazioni di lunghezza d'onda fino a 12 micrometri. Si possono costruire finestre o anche lenti. È conosciuto anche con i nomi commerciali Cleartran e Irtran-2.
Come semiconduttore[modifica | modifica wikitesto]
Sia la sfalerite che la wurtzite sono semiconduttori intrinseci a largo band gap. La sfalerite ha un band gap di 3,54 eV a 300 K mentre la wurtzite ha un band gap di 3,91 eV. Il solfuro di zinco può essere sottoposto a drogaggio sia di tipo n che di tipo p.
Tossicità / Indicazioni di sicurezza[modifica | modifica wikitesto]
ZnS è disponibile in commercio. Il composto non è classificato come pericoloso secondo la Direttiva 67/548/CEE, ma può liberare gas tossici (H2S) per contatto con acidi. Può essere nocivo per inalazione, ingestione e contatto con la pelle. Non ci sono evidenze di effetti cancerogeni. Non ci sono dati su eventuali danni all'ambiente.[10]
Note[modifica | modifica wikitesto]
- ^ a b Scheda del composto su GESTIS [1]
- ^ Sostanza non pericolosa secondo la regolamentazione (CE) N. 1272/2008.
- ^ Sidot 1866
- ^ a b c d Greenwood e Earnshaw 1997
- ^ a b Li et al. 2008
- ^ Housecroft e Sharpe 2008
- ^ a b Auer et al. 2009
- ^ Mendham et al. 2000
- ^ Franz et al. 2002
- ^ Sigma-Aldrich
Bibliografia[modifica | modifica wikitesto]
- (EN) G. Auer, P. Woditsch, A. Westerhaus, J. Kischkewitz, W.-D. Griebler e M. Liedekerke, Pigments, Inorganic, 2. White Pigments, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2009, DOI:10.1002/14356007.n20_n01, ISBN.
- (EN) K. A. Franz, W. G. Kehr, A. Siggel, J. Wieczoreck, e W. Adam, Luminescent Materials, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a15_519.
- GESTIS, Zinc sulfide, su Pagina del solfuro di zinco nel data base GESTIS. URL consultato il 4 marzo 2014.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
- (EN) W.-K. Li, G.-D- Zhou, T. C. W. Mak, Advanced Structural Inorganic Chemistry, New York, Oxford University Press, 2008, ISBN 978–0–19–921694–9.
- (EN) J. Mendham; R. C. Denney, J. D.; Barnes, M. J. K. Thomas, Vogel's Quantitative Chemical Analysis, 6ª ed., New York, Prentice Hall, 2000, ISBN 0-582-22628-7.
- M. T. Sidot, Sur les propriétés de la blende hexagonale, in Compt. Rend., vol. 63, 1866, pp. 188-189. URL consultato il 5 marzo 2014.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su solfuro di zinco
Wikimedia Commons contiene immagini o altri file su solfuro di zinco
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) zinc sulfide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Composition of CRT phosphors, su geocities.com (archiviato dall'url originale il 1º gennaio 2008).
- IR filters Università di Reading
| Controllo di autorità | Thesaurus BNCF 36255 · LCCN (EN) sh85149872 · BNF (FR) cb12482848g (data) · J9U (EN, HE) 987007534259705171 |
|---|


