Riarrangiamento di Willgerodt
Il riarrangiamento di Willgerodt, anche chiamato reazione di Willgerodt, è una reazione organica che converte un aril-alchil-chetone nel corrispondente ammide per reazione con polisolfide d’ammonio. La reazione prende il nome dal chimico Conrad Willgerodt[1][2]. La formazione del corrispondente acido carbossilico è una reazione collaterale. Quando il gruppo alchilico è una catena alifatica (intervallo compreso tra 0 e 5 atomi di carbonio), avvengono reazioni a catena che terminano posizionando il gruppo ammidico sempre sul carbonio terminale.
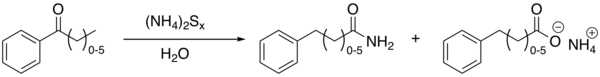
Un esempio con reagenti modificati (zolfo, idrossido d'ammonio concentrato e piridina) è la conversione di acetofenone in 2-fenilacetammide ed acido fenilacetico:[3]

Reazione di Wilgerodt-Kindler[modifica | modifica wikitesto]
La reazione di Willgerodt–Kindler[4] avviene con zolfo elementare ed un’ammina come morfolina. Il prodotto iniziale è una tioacetammide proveniente dall’acetofenone[5] che può essere ancora idrolizzato ad ammide. La reazione prende il nome da Karl Kindler.

Meccanismo di reazione[modifica | modifica wikitesto]
Un possibile meccanismo di reazione per la variazione di Kindler[6] viene mostrato a seguire:

Il primo passaggio è fondamentalmente la formazione di un’immina da un chetone e da un gruppo amminico della morfolina e l’enammina che reagisce tramite meccanismo concertato (guardare l’alchilazione delle enammine secondo Stork per i passaggi interessati) con lo zolfo del solfuro. La reazione di riarrangiamento avviene quando il gruppo amminico attacca il tiocarbonile con un'addizione nucleofila temporanea, formando un’aziridina e la tioacetamide per tautomerizzazione.
Note[modifica | modifica wikitesto]
- ^ Willgerodt, Ber., 20, 2467 (1887) DOI: 10.1002/cber.18870200278; 21, 534 (1888) DOI: 10.1002/cber.18880210195
- ^ Carmack, M.; Spielman, M. A. Org. React. 1946, 3.
- ^ The Willgerodt Reaction. II. A Study of Reaction Conditions with Acetophenone and Other KetonesDeLos F. DeTar and Marvin Carmack J. Am. Chem. Soc. 1946, 68(10), 2025 - 2029. (DOI: 10.1021/ja01214a047)
- ^ Karl Kindler, Studien über den Mechanismus chemischer Reaktionen. Erste Abhandlung. Reduktion von Amiden und Oxydation von Aminen, in Liebigs Annalen, vol. 431, n. 1, 1923, pp. 187–230, DOI:10.1002/jlac.19234310111.
- ^ Organic Syntheses, Coll. Vol. 9, p.99 (1998); Vol. 74, p.257 (1997). (Article)
- ^ Name Reactions and Reagents in Organic Synthesis Bradford P. Mundy, Michael G. Ellerd, Frank G. Jr. Favaloro 2005 ISBN 0-471-22854-0
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Riarrangiamento di Willgerodt
Wikimedia Commons contiene immagini o altri file su Riarrangiamento di Willgerodt