Frammento Fab

Il frammento Fab, o frammento legante l'antigene, è la regione dell'anticorpo che contrae legami con gli antigeni. Essa è composta da una catena proteica leggera e una pesante, ciascuna costituita da un dominio costante e da un dominio variabile. Il dominio variabile contiene il paratopo (cioè il sito di legame all'antigene), il quale comprende una sequenza di regioni determinanti la complementarità all'estremità N-terminale del monomero. Ciascuno dei due bracci dell'anticorpo, dunque, può legare un epitopo antigenico.
Isolamento del frammento Fab[modifica | modifica wikitesto]
È possibile separare i frammenti anticorpali Fab dai frammenti Fc (frammenti cristallizzati) mediante alcune tecniche di laboratorio; l'enzima papaina può essere usato per il clivaggio (scissione di una molecola in più parti funzionali) di un singolo anticorpo in due frammenti Fab e in un frammento Fc. Di converso, l'enzima pepsina divide il monomero immunoglobulinico al di sotto del punto di congiunzione tra frammenti Fab e frammento Fc, determinando una singola componente a due frammenti Fab (a cui resta legata una parte di frammento Fc) e una singola componente costituita dalla parte rimanente del frammento Fc originario. La coppia di frammenti Fab (unita ad una parte del frammento Fc) può essere successivamente scissa in due componenti uguali tra loro, attraverso una blanda ossidoriduzione.[1] Le immunoglobuline IgG, in particolare, possono essere clivate per mezzo di un enzima prodotto artificialmente di recente, IdeS (noto con il nome commerciale di FabRICATOR, è l'enzima degradatore delle immunoglobuline presente nello Streptococcus pyogenes).
-
Catene leggere e pesanti, regioni variabili e costanti di un anticorpo
-
Un anticorpo degradato dalla papaina presenta tre frammenti: due frammenti Fab e un frammento Fc
-
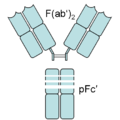
Un anticorpo degradato dalla pepsina presenta due frammenti: un frammento F(ab')2 e un frammento pFc'
Le regioni variabili delle catene leggere e delle catene pesanti possono essere fuse insieme, a costituire un frammento variabile a catena singola, le cui dimensioni sono pari alla metà di quelle di un singolo frammento Fab; i frammenti variabili a catena singola mantengono le specificità biochimiche delle immunoglobuline da cui derivano.[2]
Applicazioni[modifica | modifica wikitesto]
I frammenti Fab sono talvolta usati come antidoti in medicina d'urgenza; è in commercio il frammento Fab immune alla digossina, che può essere utilizzato come antagonista della stessa digossina in caso di morso da parte di un serpente a sonagli. Sono stati prodotti frammenti Fab progettati come antidoti della colchicina e degli antidepressivi triciclici, ma la loro messa sul mercato non è ancora stata approvata.[3][4]
I frammenti Fab rappresentano la struttura di molti anticorpi monoclonali declinati ad uso terapeutico. Tra di essi si annoverano: l'abciximab, un anticoagulante che agisce inibendo la glicoproteina IIb/IIIa presente sulla superficie delle piastrine; il ranibizumab, usato nella terapia della degenerazione maculare, il quale si lega al fattore di crescita endoteliale vascolare di tipo 1; il certolizumab pegol, consistente in un frammento Fab PEGilato e usato nel trattamento di molte patologie infiammatorie legandosi al fattore alpha di necrosi tumorale.
I frammenti Fab possono rivestire anche un ruolo diagnostico: ad esempio, l'arcitumomab è un anticorpo derivato dal topo che riconosce l'antigene carcino-embrionale, la cui espressione cellulare è aumentata nel 95% circa dei casi di tumore del colon-retto. Coniugato con un elemento radioattivo, l'arcitumomab funge da biomarcatore delle masse tumorali nella tomografia a emissione di fotone singolo. Il sulesomab, altro anticorpo monoclonale, è un antigene che riconosce le proteine sulla superficie dei granulociti e, coniugato con il tecnezio-99m, funge da biomarcatore in diverse malattie infettive.[5]
I frammenti Fab sono spesso associati a proteine piccole (il cui peso molecolare è inferiore a 100 000 dalton) per avere una minore dispersione dei fasci di radiazioni rilevati nelle immagini diagnostiche, in modo da ottenere una nitidezza e un contrasto maggiori.
Note[modifica | modifica wikitesto]
- ^ (EN) Larsson, Lars-Inge, Immunocytochemistry: Theory and practice, Crc Press, settembre 1988, p. 1, ISBN 0-8493-6078-1. URL consultato il 30 marzo 2023.
- ^ (EN) C.A. Janeway, Jr. et al., Immunobiology, 5ª ed., Garland Publishing, 2001, ISBN 0-8153-3642-X.
- ^ (EN) Flanagan RJ, Jones AL, Fab antibody fragments: some applications in clinical toxicology, in Drug Safety, vol. 27, n. 14, 2004, pp. 1115–1133, DOI:10.2165/00002018-200427140-00004, PMID 15554746.
- ^ (EN) Seger D, Kahn S, Krenzelok EP, Treatment of US crotalidae bites: comparisons of serum and globulin-based polyvalent and antigen-binding fragment antivenins, in Toxicology Reviews, vol. 24, n. 4, 2005, pp. 217–227, DOI:10.2165/00139709-200524040-00002, PMID 16499404.
- ^ (DE) W. J. Köstler, C. C. Zielinski, Diagnostische und therapeutische Antikörper in der Onkologie — State of the Art, in Acta Chirurgica Austriaca, vol. 32, n. 6, novembre 2000, pp. 260–263.