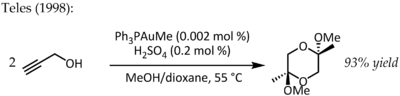Chimica dei composti organooro
La chimica dei composti di organooro è lo studio dei composti contenenti legami Au-C. Sono studiati nella ricerca universitaria ma non hanno una grande diffusione al di fuori di questa. Gli stati di ossidazione più comuni per questi composti sono I, con numero di coordinazione 2 e una geometria lineare oppure III con C.N. = 4 e una geometria quadrata planare.[1][2][3]
Oro(I)[modifica | modifica wikitesto]
I complessi d'oro(I) sono specie a due leganti, lineari, diamagnetiche, con 14 elettroni.[1][2][3] Tipicamente esistono come addotti LAuR dove L è un legando specificico, che solitamente è una trifenilfosfina o un isocianato. Il ligando serve a impedire la riduzione di Au(I) ad Au(0) metallico e la dimerizzazione del residuo organico. L'oro (I) può anche esistere come aurato M[AuR2] per cui il catione è solitamente dotato di un agente complessante per migliorare la stabilità. Anche l'anione AuR 2 − risulta lineare come altre specie con configurazione elettronica di tipo M(d10), come Hg(Me)2 e Pd(Me)22+. È stato osservato che l'oro può formare acetiluri, che sono anche capaci di formare catene polimeriche, carbeni e carbini. Il metodo classico per la preparazione dei composti LAuR è la reazione di un reattivo di Grignard con un alogenuro d'oro(I). Una successiva reazione con un organolitio R-Li forma il complesso.
Una sottoclasse speciale di questi composti è quella in cui un atomo di carbonio arilico funge da ponte tra due atomi d'oro. Ad esempio, il (MesAu)<sub id="mwLw">5</sub>, si forma in una reazione tra Au(CO)Cl e il mesitil-Grignard. Il carbonio può essere coordinato con l'oro fino a raggiungere anche 6 unità di leganti. I composti di tipo C(AuL)4 sono isolobati con il metano e quelli di tipo C(AuL)5+ lo sono con lo ione metanio. Questi cluster di organooro ipercoordinati sono spesso stabilizzati da interazioni aurofile tra i centri d'oro formalmente racchiusi all'interno.[4]
I composti del cianuro d'oro (MAu(CN)2) sono di una certa importanza per la cianurazione dell'oro, che è un processo per l'estrazione dell'oro da minerali di bassa qualità. Anche se solitamente il legame nei cianuri dei metalli è ionico, sembra esserci evidenza che il legame Au-CN in particolare sia covalente.[5]
Oro (III)[modifica | modifica wikitesto]
I complessi d'oro(III) sono tetracoordinati, di geometria quadrata planare, diamagnetici, tossici e a 16 elettroni. Quando il numero di coordinazione formale è inferiore a 4, ligandi generici come il cloro possono compensare la sottocordinazione formando un ligando a ponte. In alternativa può avvenire qualche forma di chelazione intramolecolare. In generale i composti dell'oro(III) sono tossici e quindi meno studiati dell'oro(I). In eccezione a questo fatto, i complessi di oro(III) monoarilici sono una classe di complessi ben studiata. Sono spesso preparati mediante aurazione elettrofila diretta degli areni da parte di AuCl3.[6] Complessi omolettici di tetraalchilaurato(III) (es Li[AuMe4]) sono anch'esse ben caratterizzate.[7]
Catalisi con l'oro[modifica | modifica wikitesto]
Considerazioni generali[modifica | modifica wikitesto]
La catalisi che sfrutta composti dell'oro si dividono in due categorie principali: catalisi eterogenea, che include catalizzatori di nanoparticelle d'oro (ad es. Au/TiO2 ), superfici monostrato di tiolaurati e catalizzatori su supporto di allumina, quali per esempio Au/CeO2 su allumina. Questi catalizzatori sono stati studiati per processi importanti dal punto di vista industriale come l'ossidazione degli alcoli, l'ossidazione del monossido di carbonio (CO) e varie reazioni di idrogenazione selettiva (ad es. butadiene a butene). Sebbene spesso si rivelino efficienti e mostrino interessanti proprietà di selettività se non addirittura uniche, esiste una notevole incertezza sul meccanismo dei processi con catalizzatori d'oro eterogenei, anche rispetto a applicazioni similari che usano diversi metalli di transizione.
Al contrario, la catalisi omogenea con l'oro utilizza composti di oro(I) o oro(III) sia come ioni liberi, che complessati a leganti solubili in solventi organici e viene utilizzata per la sintesi di prodotti chimici fini in chimica organica.[8][9] Alogenuri d'oro binari, tra cui cloruro d'oro (I), cloruro d'oro (III) e acido cloroaurico, sono stati impiegati come complessi. Questi composti dell'oro, tuttavia, danno rapidamente origine a catalizzatori facilmente disattivabili (tramite riduzione ad Au0). Si ha avuto un progresso importante grazie a leganti quali fosfina e NHC e ciò ha portato ad un aumento dell'interesse per le applicazioni della catalisi con composti di oro. I complessi di oro(I) sono tipicamente preparati e conservati come cloruri stabili e non reattivi di formula LAuCl. Ad esempio vi è cloro(trifenilfosfina)oro(I), che è tipicamente attivato tramite estrazione di alogenuri con sali d'argento come AgOTf, AgBF4, o AgSbF6 per generare una specie di oro cationico (I).[10][11] Sebbene il complesso coordinativamente insaturo "LAu+" sia teoricamente generato da una miscela LAuCl/AgX, l'esatta natura delle specie cationiche dell'oro e il ruolo del sale d'argento rimangono alquanto controversi.[12][13][14] Il para -nitrobenzoato, il bistriflimide e alcuni complessi di nitrile rappresentano precatalizzatori privi di argento cataliticamente attivi ma isolabili.
L'oro cationico (I) forma complessi π con legami alchenici o alchinici, seguendo il modello Dewar-Chatt-Duncanson . L'oro non è certamente l'unico metallo che mostra questo tipo di legame e reattività, lo fanno anche diversi ioni metallici con un orbitale s vuoto: ad esempio, il mercurio(II) e il platino(II). Gli ioni elettrofili e i complessi con una forte propensione a formare complessi π sono generalmente noti come pi(π)-acidi.[15]
I complessi oro(I)-alchene e -alchino sono elettrofili e, dunque, suscettibili all'attacco nucleofilo. Un processo simile è quello dell'ossimercurazione, in cui la specie intermedia contenente il mercurio richiede un passaggio aggiuntivo per liberare il prodotto. Nel caso dell'oro, è la protonolisi del legame Au-C a chiudere il ciclo catalitico, consentendo la coordinazione di un altro substrato. Alcuni vantaggi pratici della catalisi dell'oro(I) includono: 1) stabilità all'aria (a causa dell'elevato potenziale di ossidazione di Au (I)), 2) tolleranza all'umidità accidentale (a causa della sua bassa affinità per l'ossigeno) e 3) tossicità relativamente bassa rispetto ad altri pi-acidi (ad es. Pt(II) e Hg(II)). Chimicamente, i complessi Au(I) tipicamente non subiscono l'ossidazione a stati di ossidazione superiori, e gli Au(I)-alchili e -vinili non sono suscettibili all'eliminazione del β idruro.[16]
Sviluppo storico[modifica | modifica wikitesto]
Nel 1976, gli studi del gruppo di ricerca di Thomas riportarono la conversione del fenilacetilene in acetofenone utilizzando acido tetracloroaurico con una resa del 37%.[17] In questa reazione l'oro (III) è stato utilizzato come catalizzatore omogeneo in sostituzione del mercurio in quella che sarebbe stata un'ossimercurazione. Questo stesso studio elenca una resa pubblicata superiore al 150%, testimoniando una catalisi che forse non è stata riconosciuta dai chimici.
Nel 1991, Utimoto ha studiato una via catalitica che prevedeva la reazione dell'oro(III) (NaAuCl4) con alchini e acqua.[18] Teles ha identificato un grave svantaggio di questo metodo poiché Au(III) viene rapidamente ridotto a oro metallico cataliticamente inattivo e nel 1998 è tornato allo studio dell'Au(I) supportato da ligando per la trasformazione:[19]
Questa particolare reazione ha dimostrato una fantastica efficienza catalitica ed è stata la sorgente di un gran numero di ricerche sull'uso di complessi fosfina-oro(I) per l'attivazione di legami multipli C-C.[20] Nonostante la minore stabilità dei complessi dell'oro(III) in condizioni catalitiche, è stato trovato che in alcuni casi anche l'AuCl3 semplice può essere un catalizzatore efficiente. Ad esempio, Hashmi ha riportato una reazione di Diels-Alder tra un alchino e il furano catalizzata da AuCl3 che è un tipo di cicloaddizione che non si verifica normalmente se si vuole sintetizzare fenoli 2,3-disostituiti:[21]
Ulteriori studi meccanicistici hanno concluso che questa non è una reazione concertata, ma piuttosto un'iniziale idroarilazione dell'alchino seguita da una serie di riarrangiamenti intramolecolari non banali, che si concludono con un'elettrociclizzazione 6π e una riaromatizzazione.
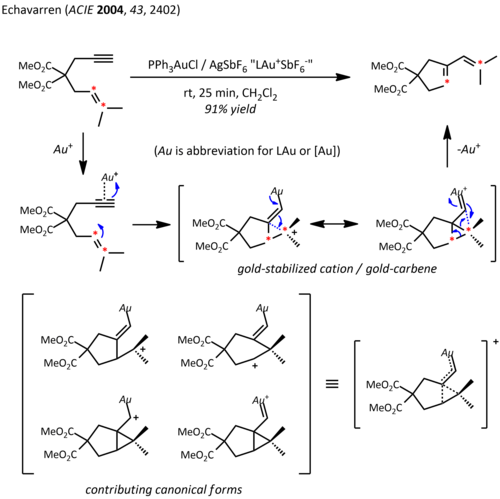
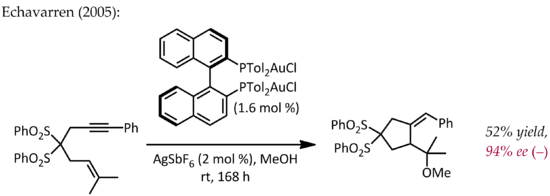
Gli effetti relativistici sono significativi nella chimica dell'organooro a causa della elevata carica nucleare del metallo (Z = 79). Come conseguenza di avere orbitali 5d espansi relativisticamente, il frammento LAu può stabilizzare un carbocatione situato nelle vicinanze tramite donazione di elettroni nell'orbitale di tipo p vuoto. Pertanto, oltre alla prevista reattività carbocationica, queste specie presentano anche un significativo carattere di carbene. Questa proprietà è stata sfruttata nelle trasformazioni catalitiche, come ad esempio nella ciclopropanazione e l'inserzione di gruppi -CH.[22] Gli esteri propargilici possono servire come precursori per intermedi cationici oro-vinilcarbene, i quali possono reagire con gli alcheni in modo concertato per fornire il prodotto di ciclopropanazione. In particolare, l'uso di un ligando chirale (( <i id="mwrg">R</i> )-DTBM-SEGPHOS) ha prodotto livelli di enantioselettività da buoni a eccellenti.[23]


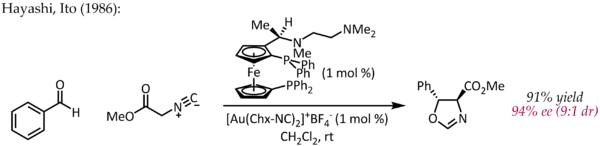
Fu Echavarren a riportare per primo la preparazione di complessi chirali bisfosfinabioro(I) con lo scopo di realizzare una catalisi enantioselettiva a base di oro e anche lui procedette attraverso il meccanismo di attivazione pi.[24] Tuttavia, un primo esempio atipico di catalisi enantioselettiva da parte dell'oro è stato descritto da Hayashi e Ito nel 1986.[25] In questo processo, la benzaldeide e l'isocianoacetato di metile subiscono la ciclizzazione in presenza di un ligando chirale ferrocenilfosfina e di un complesso bis(isocianuro)oro(I) per formare un'ossazolina chirale. Poiché le ossazoline possono essere idrolizzate per fornire un 1,2-amminoalcol, questa reazione costituisce il primo esempio di una reazione aldolica asimmetrica che procede per via catalitica.
Contrariamente alle altre reazioni sopra descritte, questa reazione non comporta l'attivazione di un doppio o triplo legame CC da parte dell'oro. Si può invece considerare che l'oro(I) si coordina simultaneamente a due ligandi fosfinici e al carbonio del gruppo isocianato[26] che viene di conseguenza attaccato dal gruppo carbonilico. Ulteriori studi sulla modalità di legame di Au(I) gettano dubbi su questa semplificazione del meccanismo.
La catalisi eterogenea ha subito uno sviluppo più antico. L'oro è un metallo interessante da usare per la sua stabilità contro l'ossidazione e per la sua morfologia varia come si può anche intuire dai cluster d'oro. Questo metallo ha dimostrato di essere efficace nell'ossidazione di CO2 a bassa temperatura e nell'idroclorurazione dell'acetilene in cloruri di vinile. L'esatta natura del sito catalitico in questo tipo di processo è ancora dibattuta.[27] L'idea che l'oro possa catalizzare una reazione non implica che sia l'unico modo. Tuttavia, altri metalli possono svolgere lo stesso lavoro con un costo di produzione inferiore, in particolare negli ultimi anni è stato di grande interesse il ferro.
Reazioni catalizzate dall'oro[modifica | modifica wikitesto]
L'oro catalizza molte trasformazioni organiche anche se solitamente si tratta della formazione di legami carbonio-carbonio da parte di Au(I) e la formazione di legami CX (X = O, N) dallo ione Au(III), a causa della più dura acidità di Lewis di quest'ultimo. Durante l'ultimo decennio, diversi studi hanno dimostrato che l'oro può catalizzare in modo efficiente le reazioni di accoppiamento incrociato C-C e C-eteroatomo che procedono attraverso un ciclo Au(I)/Au(III). Hong C. Shen ha riassunto le reazioni omogenee che formano composti ciclici in 4 categorie principali:
- addizione nucleofila di un eteroatomo a legami CC insaturi, specialmente per formare piccoli eterocicli (furani, pirroli, tiofeni)
- Idroarilazione: fondamentalmente una reazione di Friedel-Crafts che utilizza complessi metallo-alchino. Esempio, la reazione del mesitilene con il fenilacetilene :[28]
- Ciclizzazione dell'enino, in particolare cicloisomerizzazione (un primo esempio è una cicloisomerizzazione del 5-exo-dig1,6enino):[29]
- reazioni di cicloaddizione, come per esempio la cicloaddizione di un ossido di nitrile con un alchino.[30]
Altre reazioni possono comprendere l'attivazione del legame C–H[31] e reazioni aldoliche. L'oro può catalizzare anche reazioni di accoppiamento.[32]
Limitazioni[modifica | modifica wikitesto]
Mentre l'idrofunzionalizzazione catalizzata dall'oro di alchini, alleni e alcoli allilici [33] si verifica facilmente in condizioni relativamente miti, gli alcheni non attivati rimangono substrati poco efficienti nella maggior parte dei casi.[34] Ciò è dovuto in gran parte alla resistenza dei complessi intermedi di alchiloro(I) alla protodeaurazione.[35] Anche per quanto riguarda lo sviluppo delle trasformazioni intermolecolari catalizzate dall'oro, i risultati sono esigui, specie confrontando con lo sviluppo che hanno avuto le reazioni intramolecolari.[36]
Note[modifica | modifica wikitesto]
- ^ a b Elschenbroich, C. and Salzer, A. (1992) Organometallics : A Concise Introduction. Wiley-VCH: Weinheim. ISBN 3-527-28165-7
- ^ a b R. V. Parish, Organogold chemistry: II reactions, in Gold Bulletin, vol. 30, n. 2, 1997, pp. 55–62, DOI:10.1007/BF03214757.
- ^ a b R. V. Parish, Organogold chemistry: III applications, in Gold Bulletin, vol. 31, 1998, pp. 14–21, DOI:10.1007/BF03215470.
- ^ (EN) Aurophilic interactions as a subject of current research: an up-date, in Chemical Society Reviews, vol. 41, n. 1, 5 dicembre 2011, pp. 370–412, DOI:10.1039/C1CS15182G, ISSN 1460-4744, PMID 21863191.
- ^ Evidence of Significant Covalent Bonding in Au(CN)2−, in Journal of the American Chemical Society, vol. 131, n. 45, 2009, pp. 16368–70, DOI:10.1021/ja908106e, PMID 19860420.
- ^ The Chemistry of Organic Gold Compounds. III. Direct Introduction of Gold into the Aromatic Nucleus (Preliminary Communication), in Journal of the American Chemical Society, vol. 53, n. 8, 1º agosto 1931, pp. 3053–3059, DOI:10.1021/ja01359a030, ISSN 0002-7863.
- ^ Synthesis of tetramethylaurate(III). Structures of lithium dimethylaurate and lithium tetramethylaurate in solution, in Inorganic Chemistry, vol. 14, n. 10, 1º ottobre 1975, pp. 2402–2407, DOI:10.1021/ic50152a020, ISSN 0020-1669.
- ^ Gold catalysis for organic synthesis F. Dean Toste (Editor) Thematic Series in the Open Access Beilstein Journal of Organic Chemistry
- ^ The Late Start and Amazing Upswing in Gold Chemistry, in Journal of Chemical Education, vol. 91, n. 12, 2014, pp. 2024–2036, DOI:10.1021/ed400782p.
- ^ (EN) Anatomy of gold catalysts: facts and myths, in Org. Biomol. Chem., vol. 13, n. 26, pp. 7103–7118, DOI:10.1039/c5ob00736d, ISSN 1477-0539, PMID 26055272.
- ^ (EN) Development of Catalysts and Ligands for Enantioselective Gold Catalysis, in Accounts of Chemical Research, vol. 47, n. 3, pp. 889–901, DOI:10.1021/ar400188g, PMID 24228794.
- ^ (EN) Explanation of "Silver Effects" in Gold(I)-Catalyzed Hydroalkoxylation of Alkynes, in ACS Catalysis, vol. 5, n. 10, pp. 5994–6004, DOI:10.1021/acscatal.5b01493.
- ^ On the Silver Effect and the Formation of Chloride-Bridged Digold Complexes, in Organic Letters, vol. 15, n. 22, 2013, pp. 5782–5785, DOI:10.1021/ol402825v, PMID 24195441.
- ^ (EN) "Silver Effect" in Gold(I) Catalysis: An Overlooked Important Factor, in Journal of the American Chemical Society, vol. 134, n. 21, pp. 9012–9019, DOI:10.1021/ja303862z, PMID 22563621.
- ^ Catalytic Carbophilic Activation: Catalysis by Platinum and Gold π Acids, in Angewandte Chemie International Edition, vol. 46, n. 19, 2007, pp. 3410–3449, DOI:10.1002/anie.200604335, PMID 17427893.
- ^ Recent advances in syntheses of heterocycles and carbocycles via homogeneous gold catalysis. Part 1: Heteroatom addition and hydroarylation reactions of alkynes, allenes, and alkenes, in Tetrahedron, vol. 64, n. 18, 2008, pp. 3885–3903, DOI:10.1016/j.tet.2008.01.081.
- ^ The reactions of alkynes, cyclopropanes, and benzene derivatives with gold(III), in Journal of the Chemical Society, Perkin Transactions 1, n. 18, 1976, pp. 1983, DOI:10.1039/P19760001983.
- ^ Effective transformation of unactivated alkynes into ketones or acetals with a gold(III) catalyst, in The Journal of Organic Chemistry, vol. 56, n. 11, 1991, pp. 3729–3731, DOI:10.1021/jo00011a058.
- ^ <1415::AID-ANIE1415>3.0.CO;2-N Cationic Gold(I) Complexes: Highly Efficient Catalysts for the Addition of Alcohols to Alkynes, in Angewandte Chemie International Edition, vol. 37, n. 10, 1998, pp. 1415–1418, DOI:10.1002/(SICI)1521-3773(19980605)37:10<1415::AID-ANIE1415>3.0.CO;2-N, PMID 29710887.
- ^ "Black Swan Events" in Organic Synthesis, in Angewandte Chemie International Edition, vol. 51, n. 36, 2012, pp. 8936–49, DOI:10.1002/anie.201202348, PMID 22893229.
- ^ Highly Selective Gold-Catalyzed Arene Synthesis, in Journal of the American Chemical Society, vol. 122, n. 46, 2000, pp. 11553–11554, DOI:10.1021/ja005570d.
- ^ Relativistic effects in homogeneous gold catalysis, in Nature, vol. 446, n. 7134, 2007, pp. 395–403, DOI:10.1038/nature05592, PMID 17377576.
- ^ (EN) Gold(I)-Catalyzed Stereoselective Olefin Cyclopropanation, in Journal of the American Chemical Society, vol. 127, n. 51, pp. 18002–18003, DOI:10.1021/ja0552500, PMID 16366541.
- ^ (EN) Ligand Effects in Gold- and Platinum-Catalyzed Cyclization of Enynes: Chiral Gold Complexes for Enantioselective Alkoxycyclization, in Organometallics, vol. 24, n. 6, pp. 1293–1300, DOI:10.1021/om0491645.
- ^ Catalytic asymmetric aldol reaction: Reaction of aldehydes with isocyanoacetate catalyzed by a chiral ferrocenylphosphine-gold(I) complex, in Journal of the American Chemical Society, vol. 108, n. 20, 1986, pp. 6405–6406, DOI:10.1021/ja00280a056.
- ^ Chiral cooperativity: The nature of the diastereoselective and enantioselective step in the gold(I)-catalyzed aldol reaction utilizing chiral ferrocenylamine ligands, in The Journal of Organic Chemistry, vol. 55, n. 5, 1990, pp. 1649–1664, DOI:10.1021/jo00292a046.
- ^ Gold—an introductory perspective, in Chemical Society Reviews, vol. 37, n. 9, 2008, pp. 1759–65, DOI:10.1039/b810747p, PMID 18762825.
- ^ Gold-Catalyzed Hydroarylation of Alkynes, in European Journal of Organic Chemistry, vol. 2003, n. 18, 2003, pp. 3485–3496, DOI:10.1002/ejoc.200300260.
- ^ Cationic Gold(I) Complexes: Highly Alkynophilic Catalysts for theexo- andendo-Cyclization of Enynes, in Angewandte Chemie International Edition, vol. 43, n. 18, 2004, pp. 2402–2406, DOI:10.1002/anie.200353207, PMID 15114573.
- ^ Gold(III)-catalyzed one-pot synthesis of isoxazoles from terminal alkynes and nitric acid, in Journal of the American Chemical Society, vol. 115, n. 10, 1993, pp. 4401–4402, DOI:10.1021/ja00063a084.
- ^ The golden gate to catalysis, in Organic & Biomolecular Chemistry, vol. 3, n. 3, 2005, pp. 387–91, DOI:10.1039/b416516k, PMID 15678171.
- ^ Gold for C-C coupling reactions: a Swiss-Army-knife catalyst?, in Angewandte Chemie International Edition, vol. 50, n. 36, 2011, pp. 8236–47, DOI:10.1002/anie.201101603, PMID 21818831.
- ^ (EN) Allylic Alcohols: Sustainable Sources for Catalytic Enantioselective Alkylation Reactions, in Angewandte Chemie International Edition, vol. 50, n. 5, pp. 994–995, DOI:10.1002/anie.201006522, ISSN 1521-3773, PMID 21268189.
- ^ Intermolecular Hydroamination of Ethylene and 1-Alkenes with Cyclic Ureas Catalyzed by Achiral and Chiral Gold(I) Complexes, in Journal of the American Chemical Society, vol. 131, n. 15, pp. 5372–5373, DOI:10.1021/ja9001162, ISSN 0002-7863, PMID 19326908.
- ^ (EN) Alkylgold complexes by the intramolecular aminoauration of unactivated alkenes, in Chemical Science, vol. 1, n. 2, pp. 226, DOI:10.1039/C0SC00255K, PMID 24358445.
- ^ (EN) Meeting the Challenge of Intermolecular Gold(I)-Catalyzed Cycloadditions of Alkynes and Allenes, in Chemistry: An Asian Journal, vol. 9, n. 11, pp. 3066–3082, DOI:10.1002/asia.201402395, ISSN 1861-471X, PMID 25048645.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Chimica dei composti organooro
Wikimedia Commons contiene immagini o altri file su Chimica dei composti organooro