Riarrangiamento di Cope
Il riarrangiamento di Cope, noto anche come trasposizione di Cope, è una trasposizione sigmatropica [3,3] caratteristica dei 1,5-dieni che per riscaldamento tendono a formare un isomero.[1] La reazione, che prende il nome dal chimico statunitense Arthur Clay Cope che la descrisse nel 1940,[2] trova ampio utilizzo nella sintesi organica.
La flussionalità del bullvalene, semibullvalene, bullvaloni, barbaralano e composti similari è dovuta a riarrangiamenti di Cope degeneri.[3]
Il riarrangiamento di Cope non va confuso con la reazione di Cope, reazione di eliminazione data dagli N-ossidi.
Descrizione
[modifica | modifica wikitesto]Riscaldando, ad esempio, a 300 °C il 3-metil-1,5-esadiene è possibile ottenere l'1,5-eptadiene:

Se il diene presenta una simmetria in posizione 3,4, il risultato della reazione corrisponde alla molecola iniziale, senza produrre alcuna variazione osservabile:
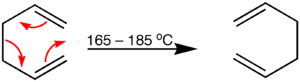
Questa trasposizione viene definita degenere[4] e origina quella che viene detta tautomeria di valenza, conferendo un carattere flussionale alle strutture molecolari, dimostrabile tramite la spettroscopia NMR.[5]
Ogni 1,5-diene è in grado di dare il riarrangiamento di Cope, ma il processo risulta favorito dalla presenza di sostituenti legati in posizione 3 o 4. La reazione avviene anche con i dieni ciclici, purché non si sia in presenza di sistemi aromatici.
Meccanismo
[modifica | modifica wikitesto]Generalmente il meccanismo di reazione procede attraverso un processo periciclico a sei centri:[6]

Lo stato di transizione può assumere una conformazione "a sedia" oppure "a barca", e la diversa conformazione assunta influenza l'isomeria geometrica del prodotto finale.
Non tutti i riarrangiamenti di Cope seguono il meccanismo appena descritto. Un meccanismo alternativo implica la formazione di un intermedio biradicalico senza che si abbia uno stato di transizione ciclico.
Varianti
[modifica | modifica wikitesto]Esistono diverse varianti del classico riarrangiamento di Cope, tra le quali spiccano l'oxo-Cope e l'aza-Cope. Un esempio del primo caso è rappresentato dalla reazione seguente:

La tautomeria cheto-enolica favorisce all'equilibrio la formazione dell'aldeide (o, eventualmente, della forma chetonica).
L'aza-riarrangiamento costituisce una delle tappe della sintesi totale della stricnina:

Note
[modifica | modifica wikitesto]- ^ Smith, p.1400
- ^ Arthur C. Cope e Elizabeth M. Hardy, The Introduction of Substituted Vinyl Groups. V. A Rearrangement Involving the Migration of an Allyl Group in a Three-Carbon System, in J. Am. Chem. Soc., vol. 62, n. 2, 1940, pp. 441–444, DOI:10.1021/ja01859a055.
- ^ (EN) Addison Ault, The Bullvalene Story. The Conception of Bullvalene, a Molecule That Has No Permanent Structure, in Journal of Chemical Education, vol. 78, n. 7, 2001-07, p. 924, DOI:10.1021/ed078p924. URL consultato il 4 luglio 2020.
- ^ (EN) degenerate rearrangement, in IUPAC Gold Book. URL consultato il 25 gennaio.
- ^ Smith, p.1404
- ^ Smith, p.1403
Bibliografia
[modifica | modifica wikitesto]- Michael B. Smith, March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 7ª ed., John Wiley & Sons, 2013, ISBN 0470462590.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Riarrangiamento di Cope
Wikimedia Commons contiene immagini o altri file su Riarrangiamento di Cope
| Controllo di autorità | GND (DE) 4113242-7 |
|---|