Sarcomero
| Sarcomero | |
|---|---|
 | |
| Nome latino | sarcomerum |
| Identificatori | |
| MeSH | A10.690.552.875.700, A11.284.430.214.190.875.820, A11.620.249.850.700 e A11.620.500.500.700 |
| FMA | 67895 |
| TI | H2.00.05.0.00008 |
Il sarcòmero (gr. σάρξ sarks 'carne, corpo', μέρος meros 'parte' ) è l'unità contrattile del tessuto muscolare striato, compresa tra due linee Z consecutive.
Le fibre muscolari contengono numerose miofibrille tubolari composte da sezioni ripetute di sarcomeri, che appaiono al microscopio ottico come un'alternanza tra bande scure e chiare. I sarcomeri sono composti da lunghe proteine fibrose che scivolano una sull'altra durante la contrazione muscolare.
Due delle proteine più importanti presenti nel sarcomero sono la miosina, che forma il filamento spesso e l'actina, che forma il filamento sottile. Le miofibrille delle cellule muscolari lisce non sono organizzate in sarcomeri. Il sarcomero è stato descritto per la prima volta da Antoni Van Leeuwenhoek.[1]
Anatomia[modifica | modifica wikitesto]
I sarcomeri sono ciò che dà ai muscoli scheletrici e cardiaci il loro aspetto striato.[2] Sono costituiti da due tipi di filamenti: quelli sottili di actina e quelli spessi di miosina. I filamenti sottili sono costituiti da due catene proteiche avvolte a spirale, mentre quelli spessi sono costituiti da sei fascetti di miosina, a loro volta divisi in catene proteiche, due catene pesanti e quattro catene leggere.
Un'estremità dei filamenti di miosina è rigonfia e prende il nome di testa della miosina e ha due funzioni: si attacca ai filamenti di actina permettendo l'accorciamento del sarcomero e inoltre funge da enzima necessario alla scissione dell'ATP in ADP+Pi (fosfato inorganico), poiché la contrazione necessita di energia.
Quando le fibre muscolari vengono stimolate, i filamenti di miosina, grazie alle teste, si legano ai filamenti di actina creando dei ponti trasversali. Le teste della miosina spingono verso l'interno i filamenti di actina, accorciando così il sarcomero.
A sostenere la struttura sarcomerica in posizione intervengono vari elementi proteici appartenenti al citoscheletro: tra questi le proteine titina e nebulina, e il costamero, che include il complesso glicoproteico associato alla distrofina (che può essere coinvolto in patologie importanti, come le distrofie muscolari).
Visione microscopica[modifica | modifica wikitesto]
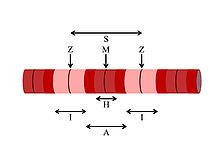
Nelle micrografie elettroniche la linea Z (dal tedesco "zwischenscheibe", disco intercalato, da "zwischen", "in mezzo a due") appare come una serie di linee scure. Le linee Z Fungono da punto di ancoraggio dei filamenti di actina.
- La banda I, di colore chiaro, si trova ai lati delle linee Z, ed è costituita da filamenti sottili di actina. Viene chiamata così perché è isotropa alla luce polarizzata.
- La banda A, di colore scuro, si trova andando verso l'interno, ed è costituita da filamenti di actina e filamenti di miosina interposti tra di loro. Viene chiamata così perché è anisotropa alla luce polarizzata.
- La banda H è una piccola zona centro della banda A che appare più chiara (dal tedesco "heller", piu chiaro). La banda H contiene solo dei filamenti spessi e non ha actina.
- La linea M, di colore scuro, si trova al centro della banda H, ed è costituita da proteine citoscheletriche che interconnettono i filamenti di miosina. Il nome deriva dal tedesco "mittelscheibe", "disco intermedio".
Quindi i filamenti di actina sono il componente principale della banda I e si estendono nella banda A. I filamenti di miosina invece si estendono per tutta la banda A e si interconnettono tra loro al centro dalla linea M.
Le bande, in base allo stato di riposo o di contrazione del muscolo, si presentano con lunghezze diverse. In condizione di riposo del muscolo, il sarcomero può avere una lunghezza di oltre 4 µm mentre in condizioni di contrazione può ridursi fino a misurare circa 1 µm.[3]
La proteina titina, si estende dalla linea Z del sarcomero, dove si lega al sistema di filamenti spessi di miosina, sino alla banda M, dove si pensa che interagisca con i filamenti spessi. La titina (e le sue isoforme) è la più grande proteina altamente elastica presente in natura. Fornisce siti di legame per numerose proteine e si ritiene che giochi un ruolo importante nell'assemblaggio del sarcomero. Si ipotizza che un'altra gigantesca proteina, la nebulina, si estenda lungo i sottili filamenti e l'intera banda I. Si pensa che agisca come la titina, e abbia un ruolo nell'assemblaggio del filamento.
Contrazione[modifica | modifica wikitesto]

Durante la contrazione le bande I e la zona H si accorciano, mentre le bande A non cambiano la loro lunghezza (1,85 micrometri nei muscoli scheletrici dei mammiferi). Questo fa sì che le linee Z si avvicinino.[4]
La proteina tropomiosina copre i siti di legame della miosina sulle molecole di actina. Per consentire alla cellula muscolare di contrarsi, la tropomiosina deve spostarsi per scoprire questi siti di legame sull'actina. Gli ioni di calcio si legano con le molecole di troponina C (disperse lungo tutta la proteina della tropomiosina) e alterano la struttura della tropomiosina, costringendola a scoprire il sito di legame del ponte sull'actina.
La concentrazione di calcio all'interno delle cellule muscolari è controllata dal reticolo sarcoplasmatico, una forma di reticolo endoplasmatico presente nel sarcoplasma . La contrazione muscolare termina quando gli ioni di calcio vengono ricaptati nel reticolo sarcoplasmatico, consentendo alle cellule muscolari di rilassarsi.
Durante la stimolazione della cellula muscolare, il neurone motorio rilascia il neurotrasmettitore acetilcolina, che viaggia attraverso la giunzione neuromuscolare (la sinapsi tra la porzione terminale del neurone e la cellula muscolare). L'acetilcolina si lega a un recettore nicotinico post-sinaptico. Il cambiamento nella conformazione del recettore consente un afflusso di ioni sodio e l'inizio di un potenziale d'azione post-sinaptico. Il potenziale d'azione quindi viaggia lungo i tubuli T fino a raggiungere il reticolo sarcoplasmatico. Qui, la membrana depolarizzata attiva i canali del calcio di tipo L voltaggio-dipendenti presenti nella membrana plasmatica. I canali del calcio di tipo L sono in stretta associazione con i recettori della rianodina presenti sul reticolo sarcoplasmatico. Il flusso interno di calcio dai canali del calcio di tipo L attiva i recettori della rianodina per rilasciare ioni calcio dal reticolo sarcoplasmatico. Questo meccanismo è chiamato rilascio di calcio indotto dal calcio. Non è chiaro se l'apertura fisica dei canali del calcio di tipo L o la presenza di calcio causi l'apertura dei recettori della rianodina. Il deflusso del calcio consente alle teste di miosina di accedere ai siti di legame dell'actina, consentendo la contrazione muscolare.[4]
Riposo[modifica | modifica wikitesto]
A riposo, la testa della miosina è legata a una molecola di ATP in una configurazione a bassa energia e non è in grado di accedere ai siti di legame cross-bridge sull'actina. Tuttavia, la testa della miosina può idrolizzare l'ATP in adenosina difosfato (ADP) e uno ione fosfato inorganico. Una parte dell'energia rilasciata in questa reazione modifica la forma della testa della miosina e promuove una configurazione ad alta energia. Attraverso il legame sull'actina, la testa della miosina rilascia ADP e uno ione fosfato inorganico, cambiando la sua configurazione di nuovo a quella di bassa energia. La miosina rimane attaccata all'actina in uno stato noto come rigore, fino a quando una nuova molecola di ATP lega la testa della miosina. Il legame dell'ATP alla miosina rilascia l'actina mediante dissociazione cross-bridge. La miosina associata all'ATP è pronta per un altro ciclo, a cominciare dall'idrolisi dell'ATP.
La maggior parte delle cellule muscolari immagazzina ATP sufficiente solo per un piccolo numero di contrazioni muscolari. Le cellule muscolari immagazzinano anche il glicogeno ma la maggior parte dell'energia richiesta per la contrazione deriva dai fosfageni. Uno di questi, la creatina fosfato, viene utilizzato come fonte di ADP e gruppo fosfato per la sintesi di ATP nei vertebrati.[4]
Note[modifica | modifica wikitesto]
- ^ A. N. Martonosi, Animal electricity, Ca2+ and muscle contraction. A brief history of muscle research, in Acta Biochimica Polonica, vol. 47, n. 3, 2000, pp. 493–516. URL consultato il 23 marzo 2019.
- ^ Campbell, Neil A., 1946-2004., Biology, 6th ed, Benjamin Cummings, 2002, ISBN 0805366245, OCLC 47521441. URL consultato il 23 marzo 2019.
- ^ Sergio Adamo, Istologia, 7. ed, Piccin, 2018, ISBN 978-88-299-2813-2, OCLC 1045938698. URL consultato il 12 maggio 2022.
- ^ a b c Lieber, Richard L., Skeletal muscle structure, function & plasticity : the physiological basis of rehabilitation, 2nd ed, Lippincott Williams & Wilkins, 2002, ISBN 0781730619, OCLC 50124456. URL consultato il 23 marzo 2019.
Bibliografia[modifica | modifica wikitesto]
- Valerio Monesi, Istologia, sesta edizione, Piccin, p. 551.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Sarcomero
Wikimedia Commons contiene immagini o altri file su Sarcomero
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) sarcomere, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
