Olefinazione di Peterson
L'olefinazione di Peterson o reazione di Peterson è una reazione chimica tra un α-silil-carbanione (indicato con 1 nello schema sottostante) e un chetone (o un'aldeide) per formare un β-idrossisilano (2), il quale dà eliminazione per formare degli alcheni (3).[1] Fu sviluppata nel 1967 dal chimico americano Donald J. Peterson (1935-2019) e oggi ne esistono molteplici varianti.[2][3][4][5][6][7] Si tratta di una reazione stereospecifica.

Meccanismo di reazione[modifica | modifica wikitesto]
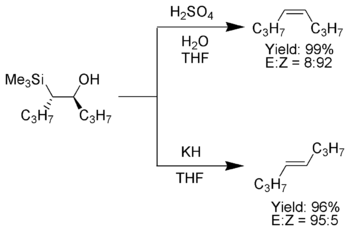
Una caratteristica saliente di questa olefinazione è il fatto che può essere usata per preparare sia alcheni cis- che alcheni trans- a partire dallo stesso beta-idrossisilano. Il trattamento di quest'ultimo con un acido darà un alchene, mentre lavorando in ambiente basico si ottiene l'alchene di stereochimica opposta.
Eliminazione in ambiente basico[modifica | modifica wikitesto]
L'impiego di una base su un β-idrossisilano (1) risulta in una eliminazione syn concertata del composto (2) o (3) per ottenere l'alchene desiderato. L'intermedio silicato penta-coordinato (3) è stato soltanto teorizzato perché ad oggi non si hanno prove sperimentali della sua effettiva formazione.
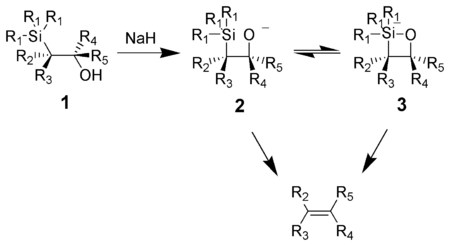
Gli alcossidi di potassio danno eliminazione velocemente, mentre quelli del sodio richiedono generalmente un po' di riscaldamento. Gli alcossidi di magnesio danno eliminazione solo in condizioni estreme. Di conseguenza, l'ordine di reattività degli alcossidi è legato alla maggiore o minore densità elettronica sull'ossigeno, dunque al concetto di nucleofilia.
Eliminazione in ambiente acido[modifica | modifica wikitesto]
Il trattamento del β-idrossisilano (1) con un acido porta alla protonazione e ad un'eliminazione anti per dare l'alchene desiderato.

Nel 2019[8] è stata sviluppata un'olefinazione di Peterson utilizzando basse quantità del catalizzatore triflimmide (HNTf2), un potente acido di Brønsted.[9] La reazione avviene a temperatura ambiente e mostra compatibilità con molti gruppi funzionali. Può essere usata anche per la sintesi degli enini.
Sostituenti alchilici[modifica | modifica wikitesto]
Quando un α-sililcarbanione contiene soltanto sostituenti alchilici, idrogeno oppure gruppi elettrondonatori, il risultato stereochimico dell'olefinazione di Peterson può essere controllato, in quanto a basse temperature l'eliminazione è lenta e il β-idrossisilano può essere isolato.[10] Una volta isolato, gli idrossisilani diastereoisomerici possono essere separati. Un diastereoisomero è trattato con un acido, l'altro con una base, portando ad alcheni della desiderata stereochimica.[4]
Se si utilizza una base di organolitio o un'ammide di litio per generare l'α-silil-carbanione, la base stessa può sortire un effetto sulla deprotonazione. Inoltre, poiché il legame Li-O non è forte quanto quello tra Mg-O, la reazione porta direttamente all'alchene.[11] Anche la variante introdotta nel 2015 da Ando et al. impiega una base di litio.[12]
Sostituenti elettron-attrattori[modifica | modifica wikitesto]
Nel caso di sostituenti elettron-attrattori sul carbanione, l'olefinazione di Peterson porta direttamente ad un alchene. L'idrossisilano intermedio non può essere isolato perché dà eliminazione in-situ.
Variazioni[modifica | modifica wikitesto]
Talvolta non è possibile lavorare in ambiente acido perché si promuoverebbe l'isomerizzazione del doppio legame. Oltretutto, l'eliminazione per mezzo di idruro di sodio o di potassio potrebbe non essere fattibile per l'incompatibilità di alcuni gruppi funzionali. Chan et al. hanno osservato che l'acilazione dell'intermedio sililcarbinolico con il cloruro di acetile o il cloruro di tionile porta a un β-silil-estere che dà eliminazione spontanea a 25 °C portando all'alchene desiderato.[13] Corey e colleghi, invece, hanno sviluppato un metodo (talvolta ribattezzato olefinazione di Corey-Peterson[14]) usando una immina sililata per restituire un'aldeide α,β-insatura da un composto carbonilico, il tutto in un solo passaggio.[15] Un esempio applicativo si ha nella sintesi totale del tassolo di Kuwajima.
Note[modifica | modifica wikitesto]
- ^ D. J. Peterson, Carbonyl olefination reaction using silyl-substituted organometallic compounds, in J. Org. Chem., vol. 33, n. 2, 1968, pp. 780–784, DOI:10.1021/jo01266a061.
- ^ Birkofer, L.; Stiehl, O. Top. Curr. Chem. 1980, 88, 58. (Review)
- ^ Ager, D. J. Synthesis 1984, 384–398. (Review)
- ^ a b Ager, D. J. Org. React. 1990, 38, 1. DOI: 10.1002/0471264180.or038.01
- ^ T. H. Chan, Alkene synthesis via β-functionalized organosilicon compounds, in Accounts of Chemical Research, vol. 10, n. 12, 1977, pp. 442–448, DOI:10.1021/ar50120a003.
- ^ New developments in the Peterson olefination reaction L. Frances van Staden, David Gravestock and David J. Ager Chem. Soc. Rev., 2002,31, 195-200 DOI: 10.1039/A908402I
- ^ Manas Das e Donal F. O’Shea, Z-Stereoselective Aza-Peterson Olefinations with Bis(trimethylsilane) Reagents and Sulfinyl Imines, in Organic Letters, vol. 18, n. 2, 15 gennaio 2016, pp. 336–339, DOI:10.1021/acs.orglett.5b03519. URL consultato il 6 gennaio 2022.
- ^ Thomas K. Britten e Mark G. McLaughlin, Brønsted Acid Catalyzed Peterson Olefinations, in The Journal of Organic Chemistry, vol. 85, n. 2, 17 gennaio 2020, pp. 301–305, DOI:10.1021/acs.joc.9b02489. URL consultato il 6 gennaio 2022.
- ^ Wanxiang Zhao e Jianwei Sun, Triflimide (HNTf2) in Organic Synthesis, in Chemical Reviews, vol. 118, n. 20, 24 ottobre 2018, pp. 10349–10392, DOI:10.1021/acs.chemrev.8b00279. URL consultato il 6 gennaio 2022.
- ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=cv9p0580.
- ^ Peterson Olefination, su www.organic-chemistry.org. URL consultato il 6 gennaio 2022.
- ^ Kaori Ando, Tomohiro Wada e Miho Okumura, Stereoselective Synthesis of Z-α,β-Unsaturated Sulfones Using Peterson Reagents, in Organic Letters, vol. 17, n. 24, 18 dicembre 2015, pp. 6026–6029, DOI:10.1021/acs.orglett.5b03008. URL consultato il 6 gennaio 2022.
- ^ T. H. Chan e E. Chang, Synthesis of alkenes from carbonyl compounds and carbanions alpha to silicon. III. Full report and a synthesis of the sex pheromone of gypsy moth, in J. Org. Chem., vol. 39, n. 22, 1974, pp. 3264–3268, DOI:10.1021/jo00936a020, PMID 4473100.
- ^ X. Zeng, F. Zeng e E. Negishi, Efficient and Selective Synthesis of 6,7-Dehydrostipiamide via Zr-Catalyzed Asymmetric Carboalumination and Pd-Catalyzed Cross-Coupling of Organozincs, in Org. Lett., vol. 6, n. 19, 2004, pp. 3245–3248, DOI:10.1021/ol048905v, PMID 15355023.
- ^ E. J. Corey, D. Enders e M. G. Bock, A simple and highly effective route to α-β-unsaturated aldehydes, in Tetrahedron Letters, vol. 17, n. 1, 1976, pp. 7–10, DOI:10.1016/S0040-4039(00)71308-6.
Voci correlate[modifica | modifica wikitesto]
- Reazione di Horner-Wadsworth-Emmons
- Olefinazione di Tebbe
- Reazione di Wittig
- Olefinazione di Julia
- Riarrangiamento di Brook
- Alcheni
- Reazione di eliminazione
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Olefinazione di Peterson
Wikimedia Commons contiene immagini o altri file su Olefinazione di Peterson