Legami intermolecolari
I legami intermolecolari sono interazioni di natura elettrostatica che si generano non fra singoli atomi, ma fra molecole neutre e ioni.[1] Queste interazioni possono essere causate sia da molecole il cui momento dipolare risultante è non nullo, sia da molecole che subiscono una polarizzazione, ma sono in generale caratterizzate da un'energia più debole rispetto ai legami intramolecolari.[2][3] Divengono spesso fondamentali nel determinare le proprietà fisiche e chimiche di alcune sostanze o in campi come il docking di un farmaco.[4][3]
Descrizione
[modifica | modifica wikitesto]Le forze intermolecolari possono essere attrattive o repulsive e si esplicano tra due o più molecole, che possono essere uguali, nel caso in cui la sostanza sia pura, oppure diverse fra loro, nel caso di una miscela o se prese nella zona di separazione fra due materiali differenti.[3]
Questo tipo di forze nasce fra molecole in cui il baricentro delle cariche negative non coincide con il baricentro delle cariche positive. Ciò è dovuto al fatto che alcune molecole presentano un momento dipolare risultante non nullo, e si comportano dunque come dei deboli dipoli elettrici.
Le forze intermolecolari contribuiscono a determinare alcune caratteristiche fisiche delle sostanze. All'interno di un gas, ad esempio, le molecole si trovano a distanze tali per cui la forza risulterà in media di valore piccolo, essendo queste dotate di un'alta energia cinetica. Ciò permette dunque al gas di espandersi fino ad occupare sempre l'intero volume a sua disposizione.[5] Al contrario, allo stato liquido (e ancora di più allo stato solido) queste interazioni sono più forti e causano dunque una maggior compattezza della sostanza, insieme ad una minore mobilità delle molecole.[1]
Le forze intermolecolari determineranno quindi quali saranno le proprietà fisiche di una sostanza, soprattutto nei passaggi di stato che coinvolgono i liquidi (solido-liquido e liquido-gas).[6] Un'elevata forza fra le molecole di una soluzione (ad esempio un legame ad idrogeno, come nel caso dell'acqua) fa innalzare il punto di ebollizione di quest'ultima, perché riuscire a portare le molecole in fase vapore risulta più costoso in termini energetici (presumibilmente fornendo energia sotto forma di calore) per rompere questi legami. Stesso discorso si può fare per il punto di fusione.[7]
Forze di van der Waals
[modifica | modifica wikitesto]Le forze di van der Waals, che prendono il nome dal fisico olandese Johannes Diderik van der Waals, sono un insieme di interazioni intermolecolari che comprende le Forze di London e le interazioni dipolo-dipolo.[6]
Le forze di Van der Waals sono interazioni che riguardano sia molecole polari, sia molecole apolari, appartenenti allo stato liquido e allo stato solido della materia, e fanno sì che le molecole appartenenti a questi due stati di aggregazione siano più compatti e meno mobili.[8]
Le forze di van der Waals si possono avere quando si verifica:
- un'attrazione tra dipoli permanenti (in questo caso prende il nome di interazione di Keesom);
- un'attrazione tra dipolo permanente e dipolo indotto (in questo caso prende il nome di forza di Debye);
- un'attrazione tra dipolo istantaneo e dipolo indotto (in questo caso si parla di forza di London)[9]
Forza di dispersione di London
[modifica | modifica wikitesto]
Le forze di London, che prendono il nome dal fisico Fritz London, sono il tipo di interazione intermolecolare più debole e si manifestano a causa dello spostamento temporaneo delle cariche che formano la nuvola elettronica di una molecola. Questo fa sì che le forze di London si generino anche fra molecole apolari o tra gas nobili, dato che negli atomi (o molecole) in cui la distribuzione di carica è mediamente simmetrica, essa non la è istantaneamente.[4] Conseguentemente si origina una molecola dotata istantaneamente di una debole carica elettrica, ossia un dipolo istantaneo, il quale fa nascere un campo elettrico che influenza e polarizza tramite induzione gli atomi circostanti, detti dipoli indotti. L'effetto a catena che si crea genera legami momentanei fra gli atomi, che presi tutti insieme si possono sovrapporre in modo significativo alle altre eventuali forze intermolecolari o interioniche.[10]
L'effetto attrattivo che nasce fra i vari dipoli è quantificato dall'energia E espressa nell'equazione di London:
in funzione della polarizzabilità α, dell'energia di ionizzazione Ei e della distanza r.[4] Si può notare come questa energia sia non trascurabile solo per distanze estremamente piccole, ecco perché queste interazioni vengono anche chiamate forze a corto raggio.
Le forze di London sono le uniche forze agenti fra molecole di gas nobili, e permettono loro di esistere anche allo stato liquido, inoltre sono in grado di influenzare proprietà come la temperatura di ebollizione o la densità di alcune sostanze, ad esempio gli idrocarburi.[3][11]
Inoltre, vengono dette anche forze di dispersione in quanto il fenomeno alla base della loro natura genera anche la dispersione della luce da parte delle molecole.[12]
Forza di Debye
[modifica | modifica wikitesto]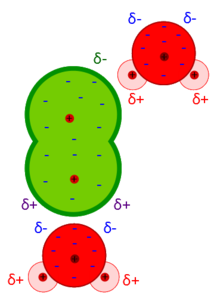
Le forze di Debye, chiamate anche forze di induzione, sono molto deboli e si manifestano fra una molecola polare e una apolare.[11] A causa della vicinanza con uno ione infatti, in una molecola apolare si genera un momento dipolare indotto, di intensità direttamente proporzionale al campo elettrico generato dallo ione. L'energia esercitata segue la relazione:
dove μ misura l'intensità del momento di dipolo permanente, α' il volume di polarizzabilità della molecola e ε0 corrisponde alla costante dielettrica del vuoto.[13]
Interazione di Keesom
[modifica | modifica wikitesto]Queste interazioni elettrostatiche, dette anche interazioni dipolo - dipolo, nascono fra due molecole entrambe dotate di un proprio momento dipolare, le quali tendono a disporsi in modo da avvicinare i poli di carica opposta.[11]
La configurazione così raggiunta tende a essere molto stabile, specialmente se le forze sono intense. Ciò non accade ad esempio nei gas, in cui le distanze intermolecolari sono troppo elevate per far sì che il contributo delle interazioni di Keesom sia rilevante, a causa anche della forte agitazione delle particelle che tende a rompere la struttura ordinata.[11] Solo abbassando la temperatura o alzando la pressione le distanze fra le molecole diminuiscono e si ha un conseguente aumento della coesione fra esse, proprio a causa di queste forze, che può portare anche al passaggio allo stato liquido. Analogamente, per temperature ancora più basse o pressioni ancora più alte, si ha il passaggio allo stato solido, caratterizzato da una stabilità ancora maggiore.[14]
L'interazione di Keesom è quantificabile in due modi differenti, a seconda dello stato delle sostanze in gioco:
- Nel caso di una sostanza liquida o gassosa, in cui i dipoli possono dunque ruotare, si ha
dove k corrisponde alla costante di Boltzmann, μ1 e μ2 ai momenti dipolari delle due molecole, ε0 alla costante dielettrica nel vuoto e r alla distanza fra i due dipoli.
- Nel caso di una sostanza solida, in cui i dipoli sono stazionari, si ottiene
dove θ1, θ2, e φ sono gli angoli che caratterizzano l'orientazione reciproca fra i due dipoli.[14]
Legame a idrogeno
[modifica | modifica wikitesto]

Alcuni liquidi presentano punti di ebollizione molto più alti dei valori prevedibili considerando solo le interazioni dipolari, questo indicò agli scienziati la presenza di forze intermolecolari più accentuate. In particolare si scoprì una forza d'attrazione tra le molecole, dovuta al legame a idrogeno. Nelle molecole in cui un atomo di idrogeno è legato a uno o più atomi piccoli elettronegativi ( l'Azoto, l'Ossigeno o il Fluoro), è presente questo effetto. Infatti la presenza di un forte atomo elettronegativo, legato covalentemente ad un idrogeno crea un forte dipolo, in cui l'atomo di idrogeno rappresenta la parte positiva. Questa disposizione degli atomi produce un legame molto polare, quindi una molecola polare con forti interazioni di attrazione intermolecolari. Nonostante il legame idrogeno sia più debole rispetto ai legami presenti all'interno delle molecole (legami intramolecolari) è la maggiore forza d'attrazione tra le molecole (forze intermolecolari).[6] Lo dimostra il fatto che la sua energia di legame (tra 20 e 50 kJ/mol) è nettamente superiore rispetto a quella delle altre forze intermolecolari.[16] La protonazione dell atomo di Idrogeno (H → H +) è tale da consentire ad esso di legare, con un legame elettrostatico, un altro atomo elettronegativo.Ne sono esempi composti chimici come l'acqua (H 2O), l'ammoniaca (NH 3) e il fluoruro di idrogeno(HF).[16] Il legame idrogeno ha un'influenza estremamente importante sul comportamento di molti sistemi biologici. Molecole come le proteine e il DNA richiedono una rete di legami idrogeno per mantenere le loro strutture e le loro funzioni.[6] Nel DNA infatti i legami idrogeno fra le basi azotate di due filamenti sono responsabili della struttura a doppia elica. Anche se l’energia necessaria per rompere il singolo legame idrogeno è piccola, in condizioni fisiologiche la struttura a doppia elica è stabilizzata proprio dal numero elevatissimo di legami idrogeno presenti.[15]
Interazione ione-dipolo
[modifica | modifica wikitesto]L'interazione fra ioni e dipoli, generalmente compresa fra 40-600 kJ/mol, avviene all'interno di soluzioni di soluti ionici in particolari solventi polari, in quanto le molecole del solvente tendono a comportarsi come dipoli elettrici, mentre il soluto viene dissociato in ioni positivi e ioni negativi.[10]
Un esempio molto semplice di questa attrazione è dato dallo scioglimento del sale da cucina nell'acqua: il sale è formato dagli ioni di sodio Na+ e cloro Cl-, i quali generano ciascuno un campo elettrico che permette alle molecole d'acqua, assimilabili a dipoli elettrici, di attrarre ciascuno ione.[17]
In generale, questa forza è vinta spesso sia dagli urti molecolari, sia dai moti termici, anche se alcuni metalli di transizione riescono a formare dei veri e propri legami covalenti (con alcune molecole) grazie ai loro ioni, per formare così i composti di coordinazione, dei composti particolarmente stabili.[18]
Questa interazione può essere quantificata anche tramite la differenza di energia libera di Gibbs calcolata tra i casi in cui ci siano e non ci siano tali interazioni, ma solo se è valida l'ipotesi di diluizione infinita.[3]
Legame ad alogeno
[modifica | modifica wikitesto]Il legame ad alogeno è un’interazione non covalente che si instaura tra un atomo di alogeno legato covalentemente, che agisce da elettrofilo, ed una specie nucleofila.[19] È un legame polare Carbonio-Alogeno forte (la sua forza è compresa tra i 5 e i 180 KJ/mol), dovuto al fatto che il legame avviene tra due ioni, può essere quindi sensibilmente più forte rispetto al legame a idrogeno. Tutti gli alogeni possono formare questo legame, nonostante il Fluoro vi partecipi più raramente.[20]
Il legame ad alogeno è una delle proprietà degli alogenuri alchilici, dei quali determina la reattività. Infatti l'atomo elettronegativo dell'alogeno crea un legame C-X (dove C rappresenta l'atomo di Carbonio e X quello di un alogeno) polare, rendendo di conseguenza elettron-povero l'atomo di Carbonio. La polarità di questo legame inoltre determinerà la chimica stessa degli alogenuri alchilici.[21] Un esempio di questa interazione si può ben notare quindi nella reazione di alogenuri alchilici con un nucleofilo:
CH3C+H2-Cl(-) + :Nu-
Dove il Carbonio (il secondo nella formula qui rappresentata) viene caricato come uno ione positivo (elettrofilo, o elettron-povero) da una interazione intramolecolare non covalente dovuta alla presenza dell'alogeno (in questo caso il Cloro),e reagisce per questo con un nucleofilo (in questo caso rappresentato genericamente) elettron-ricco.[22]
Note
[modifica | modifica wikitesto]- ^ a b Legami intermolecolari e Forze di Van der Waals, su chimica-online.it. URL consultato il 25/04/19 alle 12:30.
- ^ Elementi di chimica – Roberto Spinicci - Firenze University Press, pp. 225-226.
- ^ a b c d e Legami intermolecolari [collegamento interrotto], su chimicando.altervista.org. URL consultato il 24/04/19 alle 19:15.
- ^ a b c Malucelli, Giulio., Elementi di chimica per l'ingegneria, Libreria editrice universitaria Levrotto & Bella, 2002, p. 145.
- ^ Elementi di chimica – Roberto Spinicci - Firenze University Press, p. 238.
- ^ a b c d Elisabetta Brenna, Paola D'Arrigo e Giuseppina Raffaini, 5.2.4, in Fondamenti di Chimica e Chimica Organica per Ingegneria Biomedica, Mc Graw-Hill Education, 2015, p. 233.
- ^ Legami intermolecolari, su gmpe.it. URL consultato il 21/04/19 alle 19:20.
- ^ Legami intermolecolari e Forze di Van der Waals, su chimica-online.it. URL consultato il 3 maggio 2019.
- ^ Legami intermolecolari, su gmpe.it. URL consultato il 6 maggio 2019.
- ^ a b Elementi di chimica – Roberto Spinicci - Firenze University Press, p. 227.
- ^ a b c d Elementi di chimica per l’ingegneria - Giulio Malucelli – Nerino Penazzi 2002 Levrotto & Bella di Gualini, Torino, p. 146.
- ^ Elementi di chimica per l’ingegneria - Giulio Malucelli – Nerino Penazzi 2002 Levrotto & Bella di Gualini, Torino, p. 145.
- ^ Interazione dipolo permanente - dipolo indotto, su chimica-online.it. URL consultato il 3 maggio 2019 alle 22:08.
- ^ a b Interazione dipolo-dipolo, su chimica-online.it.
- ^ a b Hydrogen bond, su whatischemistry.unina.it. URL consultato l'8 maggio 2019.
- ^ a b Legame idrogeno, su chimica-online.it. URL consultato l'8 maggio 2019.
- ^ Malucelli Giulio, Nerino Penazzi, Elementi di Chimica per l'Ingegneria, p. 147.
- ^ Elementi di chimica – Roberto Spinicci - Firenze University Press, p. 228.
- ^ Gabriella Cavallo, Francesca Baldelli Bombelli, Pierangelo Metrangolo, Tullio Pilati, Giuseppe Resnati, Giancarlo Terraneo, Benvenuto al primo simposio internazionale sul legame ad alogeno (PDF), su soc.chim.it.
- ^ P. Politzer, P. Lane, M.C. Concha, Y. Ma, J.S. Murray, An overview of halogen bonding, in J. Mol. Model., vol. 13, n. 2, 2007, pp. 305-11, DOI:10.1007/s00894-006-0154-7, PMID 17013631.
- ^ Elisabetta Brenna, Paola D'Arrigo e Giuseppina Raffaini, 7.4, in Fondamenti di Chimica e Chimica Organica per Ingegneria Biomedica, Mc Graw-Hill Education, 2015, p. 528.
- ^ Elisabetta Brenna, Paola D'Arrigo e Giuseppina Raffaini, 3.5, in Fondamenti di Chimica e Chimica Organica per Ingegneria Biomedica, Mc Graw-Hill Education, 2015, p. 248-249.
Bibliografia
[modifica | modifica wikitesto]- Roberto Spinicci, Elementi di chimica, Firenze University Press, 2009, ISBN 978-88-6453-064-2
- Giulio Malucelli, Nerino Penazzi, Elementi di Chimica per l'Ingegneria, Levrotto & Bella, Torino, 2006, ISBN 88-8218-085-9
- Maria Elisabetta Brenna, Paola D'Arrigo e Giuseppina Raffaini, Fondamenti di Chimica e Chimica Organica per Ingegneria Biomedica, Mc Graw-Hill Education, 2015, ISBN 978-1-3085-7836-1.
Voci correlate
[modifica | modifica wikitesto]- Legame chimico
- Molecola
- Dipolo molecolare
- Ingegneria chimica
- Johannes Diderik van der Waals
- Forza intramolecolare
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su legame intermolecolare
Wikimedia Commons contiene immagini o altri file su legame intermolecolare
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) intermolecular forces, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | LCCN (EN) sh85067312 · GND (DE) 4191346-2 · J9U (EN, HE) 987007555509005171 · NDL (EN, JA) 00576112 |
|---|



