Esafluoruro di platino
| Esafluoruro di platino | |
|---|---|
 | |
| Nome IUPAC | |
| Esafluoruro di platino, fluoruro di platino(VI) | |
| Caratteristiche generali | |
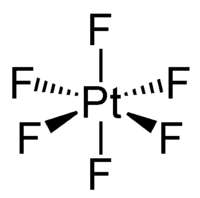
| Formula bruta o molecolare | PtF6 |
| Massa molecolare (u) | 309,07 |
| Aspetto | cristalli rosso scuro |
| Numero CAS | |
| Numero EINECS | 237-214-0 |
| PubChem | 3014771 |
| SMILES | F[Pt-4](F)(F)(F)(F)F |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 5,21 (–140 °C)[1] |
| Solubilità in acqua | reazione violenta[2] |
| Temperatura di fusione | 61,3 °C (334 K)[3] |
| Temperatura di ebollizione | 69,1 °C (342 K)[3] |
| Indicazioni di sicurezza | |
L'esafluoruro di platino o fluoruro di platino(VI) è il composto binario di formula PtF6. È l'unico esempio di composto del platino con numero di ossidazione +6. In condizioni normali è un solido rosso scuro che vaporizza formando un gas rosso. PtF6 è una delle molecole con più alta affinità elettronica note (7,0 eV).[4] Fortissimo ossidante e agente fluorurante, è famoso per aver permesso al chimico britannico Neil Bartlett di preparare il primo composto di gas nobili.[3][5]
Struttura molecolare e configurazione elettronica[modifica | modifica wikitesto]
PtF6 è un composto molecolare; nella molecola l'atomo di platino ha coordinazione ottaedrica sia allo stato solido che in fase gassosa. Allo stato solido cristallizza nel sistema ortorombico, gruppo spaziale Pnma, con costanti di reticolo a = 937,4 pm, b = 852,7 pm e c = 493,3 pm, quattro unità di formula per cella elementare, e densità calcolata di 5,21 g/dm³.[1]
Il platino(VI) ha configurazione elettronica d4, facendo prevedere una distorsione dell'ottaedro in base all'effetto Jahn-Teller. Sperimentalmente tale distorsione è stata osservata con distanze Pt–F che variano da 184,4 a 185,8 pm tramite uno studio di diffrazione neutronica su polveri.[6] Un successivo studio di diffrazione a raggi X su cristalli singoli non ha evidenziato invece alcuna distorsione sostanziale, osservando distanze Pt–F tra 184,8 e 185,1 pm.[1]
Sintesi[modifica | modifica wikitesto]
PtF6 è stato sintetizzato per la prima volta nel 1957 facendo reagire fluoro gassoso con un filamento di platino riscaldato tramite una corrente elettrica:[7]
- Pt + 3F2 → PtF6
Alternativamente si può ottenere per disproporzione dal pentafluoruro di platino:[2][3]
- 2PtF5 → PtF6 + PtF4
Note[modifica | modifica wikitesto]
Bibliografia[modifica | modifica wikitesto]
- (EN) R. H. Crabtree e H. Torrens, Platinum: Inorganic & Coordination Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia194, ISBN 9780470862100.
- (EN) T. Drews, J. Supeł, A. Hagenbach e K. Seppelt, Solid State Molecular Structures of Transition Metal Hexafluorides, in Inorg. Chem., vol. 45, n. 9, 2006, pp. 3782-3788, DOI:10.1021/ic052029f.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) R. Marx, K. Seppelt e R. M. Ibberson, Time‐of‐flight neutron powder diffraction study on the third row transition metal hexafluorides WF6, OsF6, and PtF6, in J. Chem. Phys., vol. 104, 1996, p. 7658, DOI:10.1063/1.471473.
- (EN) B. Weinstock, H. H. Claassen e J. G. Malm, Platinum Hexafluoride, in J. Am. Chem. Soc., vol. 79, n. 21, 1957, pp. 5832-5832, DOI:10.1021/ja01578a073.
- (EN) R. Wesendrup e P. Schwerdtfeger, Structure and Electron Affinity of Platinum Fluorides, in Inorg. Chem., vol. 40, n. 14, 2001, pp. 3351-3354, DOI:10.1021/ic010169t.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Esafluoruro di platino
Wikimedia Commons contiene immagini o altri file su Esafluoruro di platino