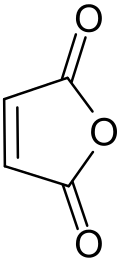
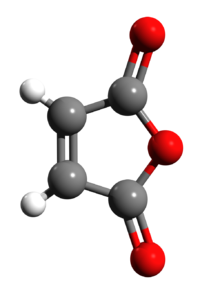
Anidride maleica
| Anidride maleica | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 2-ossolen-1,4-dione | |
| Nomi alternativi | |
| anidride cis-butendioica anidride toxilica diidro-2,5-diossofurano | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H2O3 |
| Massa molecolare (u) | 98.06 |
| Aspetto | cristalli bianchi |
| Numero CAS | |
| Numero EINECS | 203-571-6 |
| PubChem | 7923 |
| SMILES | C1=CC(=O)OC1=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1.314 |
| Solubilità in acqua | 572g/l a 20 °C |
| Temperatura di fusione | 53 °C (326 K) |
| Temperatura di ebollizione | 202 °C (475 K) |
| Tensione di vapore (Pa) a 44 °C K | 1,33 hPa |
| Indicazioni di sicurezza | |
| Punto di fiamma | vaso aperto: 110 °C (383 K) vaso chiuso: ca. 102 °C (375 K) |
| Limiti di esplosione | 7,1%-1,4% |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 302 - 314 - 334 - 317 |
| Consigli P | 280 - 301+330+331 - 305+351+338 - 304+340 - 302+352 - 309+310 [1] |
L'anidride maleica (nota che come "anidride cis-butendioica", "anidride toxilica", "diidro-2,5-diossofurano") è un composto organico con formula bruta C4H2O3, che, quando puro, si presenta come un solido incolore o bianco con un odore acre.
Sintesi[modifica | modifica wikitesto]
L'anidride maleica viene prodotta per ossidazione dal benzene o dal n-butano. La produzione dal benzene è una tecnologia vecchia e utilizza reattori tubolari a letto fisso e data la classificazione H350 della materia prima in Europa è utilizzata solo in pochi e per lo più piccoli impianti. La produzione da butano utilizza reattori a letto fluido, con la stechiometria di reazione riportata qui di seguito:
- CH3CH2CH2CH3 + 3.5 O2 → C2H2(CO)2O + 4 H2O
Proprietà e reattività chimica[modifica | modifica wikitesto]
L'anidride maleica ha una reattività molto interessante in quanto può reagire sia al doppio legame che al gruppo anidridico.
Le reazioni di addizione al doppio legame tipiche della maleica sono:
- Reazione di Diels-Alder, essendo l'anidride maleica un forte dienofilo.
- Idratazione con produzione di acido malico HOOCCH2-CHOH-COOH e come sottoprodotto l'acido fumarico.
Le reazioni del gruppo anidridico della maleica sono:
- idrolisi con produzione di acido maleico, cis-HO2CCH=CHCO2H
- Esterificazione con la produzione del mono o di-estere, per es. cis-HO2CCH=CHCO2CH3
Note[modifica | modifica wikitesto]
- ^ scheda dell'anidride maleica su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
Bibliografia[modifica | modifica wikitesto]
- (EN) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Industrial organic chemistry, 4ª ed., Wiley-VCH, 2003, pp. 367-375, ISBN 3-527-30578-5.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su anidride maleica
Wikimedia Commons contiene immagini o altri file su anidride maleica
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) maleic anhydride, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | LCCN (EN) sh85080133 · GND (DE) 4168706-1 · J9U (EN, HE) 987007545954705171 |
|---|