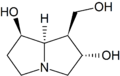Alcaloide pirrolizidinico

Gli alcaloidi pirrolizidinici (PA) costituiscono un gruppo di alcaloidi formalmente derivati della pirrolizidina comprendente composti molto tossici, soprattutto a livello epatico. Più di 660 PA e PA N-ossidi (PANO) sono stati identificati in oltre 6.000 piante, e circa la metà di essi presentano epatotossicità.[1] Si trovano in vegetali appartenenti alle famiglie delle Boraginaceae, Asteraceae, Orchidaceae e Leguminosae, meno frequentemente nelle Convolvulaceae e Poaceae, e in almeno una specie delle Lamiaceae. È stato stimato che il 3% delle piante da fiore del mondo contengono alcaloidi pirrolizidinici.[2] Sono prodotti come meccanismo di difesa contro insetti fitofagi e animali erbivori.
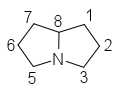
Struttura
[modifica | modifica wikitesto]La maggior parte degli alcaloidi pirrolizidinici sono esteri prodotti della reazione tra un amminoalcol e uno o due acidi carbossilici alifatici.

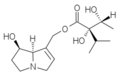
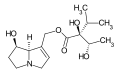
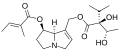
Principali caratteristiche strutturali di un tipico alcaloide pirrolizidinico (senecionina):
Riquadro rosso: gruppo ossidrilico esterificato in C9
Riquadro verde: gruppo ossidrilico esterificato in C7
Riquadro blu: doppio legame tra C1-C2
Riquadro arancione in alto: acido necico (acido senecico)
Riquadro arancione in basso: base necina (retronecina)
Basi necine
[modifica | modifica wikitesto]Gli amminoalcol derivano formalmente dalla pirrolizidina, che costituisce lo scheletro biciclico, e prendono il nome di necine o basi necine. Costituiscono gli alcaloidi pirrolizidinici più semplici e la base per la formazione di nuovi PA complessi tramite esterificazione con gli acidi necici.
-
Pirrolizidina
-
Supinidina
-
Eliotridina
-
Retronecina
Il legame C1-C2 è generalmente un doppio legame ma non necessariamente, come nel caso della platinecina e rosmarinecina
-
Platinecina
-
Rosmarinecina
In alcune necine può essere assente il legame tra atomo di carbonio e azoto, come nel caso della otonecina

Le necine presentano sempre un gruppo idrossimetile (-CH2-OH) in C-1 e talvolta un gruppo ossidrilico secondario in C-7 (retronecina, eliotridina) in C-2 (rosmarinecina) e in C-6 (crotanecina).
Acidi necici
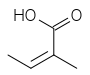
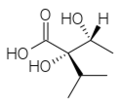
[modifica | modifica wikitesto]Gli acidi coinvolti nelle reazioni di esterificazione sono chiamati acidi necici. Questi sono alifatici e possono essere C5 (acido angelico, acido tiglico), C7 (acido lasiocarpico, acido (+)-trachelantico, acido (-)-viridiflorico, ecc), C8 (acido monocrotalico) oppure C10 (acido senecico, acido riddelico)
-
Acido angelico
-
Acido tiglico
-
Acido (+)-trachelantico
-
Acido riddelico
Esteri risultanti
[modifica | modifica wikitesto]I composti risultanti sono mono e diesteri
-
Intermedina
-
Licosamina
-
Simfitina (7-tiglil-9-viridiflorilretronecina)
o diesteri macrociclici (in questo caso i 7,9-dioli pirrolizidinici sono esterificati con un acido dicarbossilico)
-
R=H : senecionina
R=OH : retrorsina -
Senkirkina
Ecologia
[modifica | modifica wikitesto]Alcuni lepidotteri, in particolare alcune specie di Arctiidae, utilizzano gli alcaloidi pirrolizidinici come precursori per la sintesi di feromoni[3] e per difendersi contro i predatori.[4]
Sicurezza alimentare
[modifica | modifica wikitesto]Il miele può contenere alcaloidi pirrolizidinici,[5][6] così come i cereali, latte, frattaglie e uova.[7][8] Fino ad oggi non esiste un regolamento internazionale degli PA negli alimenti, a differenza degli PA presenti nelle erbe e farmaci.[9][10]
Tossicologia
[modifica | modifica wikitesto]Gli alcaloidi pirrolizidinici 1,2-insaturi sono epatotossici.[11][12] PA possono causare la malattia veno-occlusiva (VOD) epatica[13][14][15] e cancro del fegato.[16]
Specie di piante contenenti alcaloidi pirrolizidinici
[modifica | modifica wikitesto]| Famiglia | Nome comune | Nome botanico | Principali PA presenti |
|---|---|---|---|
| Boraginaceae | Borragine | Borago officinalis L.[17] | licosamina, amabilina, supinidina |
| Consolida maggiore | Symphytum officinale L..[14] | licosamina, sinfitina | |
| Eliotropo | Heliotropium europaeum L.[18] | eliotrina, lasiocarpina | |
| Eliotropo indiano | Heliotropium indicum L.[19][20] | indicina, acetil-indicina, indicinina | |
| Viperina piantaginea | Echium plantagineum L.[21] | echimidina, licosamina | |
| Asteraceae | Agerato o celestino | Ageratum houstonianum Mill.[22] | licosamina, esteri della retronecina |
| Canapa acquatica | Eupatorium cannabinum L. | echinatina, licosamina, intermedina, rinderina | |
| Senecione di San Giacomo | Jacobaea vulgaris Gaertn.[23][24] | senecionina, esteri della retronecina | |
| Senecione comune | Senecio vulgaris L.[25][26] | senecionina, senecionina N-ossido | |
| Senecione di Riddell | Senecio riddellii Torr. & A. Gray[27] | riddelliina | |
| Tossilaggine comune | Tussilago farfara L.[28] | senchirchina, senecionina |
Note
[modifica | modifica wikitesto]- ^ (EN) A. R. Mattocks, Toxicity of Pyrrolizidine Alkaloids, in Nature, vol. 217, n. 5130, 1968, pp. 723-728, DOI:10.1038/217723a0.
- ^ (EN) L. W. Smith and C. C. J. Culvenor, Plant Sources of Hepatotoxic Pyrrolizidine Alkaloids, in Journal of Natural Products, vol. 44, n. 2, 1981, pp. 129-152, DOI:10.1021/np50014a001.
- ^ (EN) Gadi V.P Reddy and Angel Guerrero, Interactions of insect pheromones and plant semiochemicals, in Trends in Plant Science, vol. 9, n. 5, 2004, pp. 253-261, DOI:10.1016/j.tplants.2004.03.009.
- ^ (EN) Michael Boppré, Lepidoptera and pyrrolizidine alkaloids Exemplification of complexity in chemical ecology, in Journal of Chemical Ecology, vol. 16, n. 1, 1990, pp. 165-185, DOI:10.1007/BF01021277.
- ^ (EN) M. Kempf, A. Reinhard, and T. Beuerle, Pyrrolizidine alkaloids (PAs) in honey and pollen-legal regulation of PA levels in food and animal feed required, in Molecular Nutrition & Food Research, vol. 54, n. 1, 2010, pp. 158-168, DOI:10.1002/mnfr.200900529.
- ^ (EN) J. A. Edgar, E. Roeder, and R. J. Molyneux, Honey from Plants Containing Pyrrolizidine Alkaloids: A Potential Threat to Health, in Journal of Agricultural and Food Chemistry, vol. 50, n. 10, 2002, pp. 2719-2730, DOI:10.1021/jf0114482.
- ^ (EN) John A. Edgar, and Leslie W. Smith, Transfer of Pyrrolizidine Alkaloids into Eggs: Food Safety Implications, vol. 745, 1999, pp. 118-128, DOI:10.1021/bk-2000-0745.ch008.
- ^ (EN) Pyrrolizidine Alkaloids in Food Copia archiviata (PDF), su foodstandards.gov.au. URL consultato il 5 marzo 2011 (archiviato dall'url originale il 14 ottobre 2009)..
- ^ (EN) Coulombe, Roger A., Jr., Pyrrolizidine alkaloids in foods, in Advances in Food and Nutrition Research, vol. 45, 2003, pp. 61-99.
- ^ German Commission E monographs.
- ^ (EN) Foodborne Pathogenic Microorganisms and Natural Toxins Handbook: Pyrrolizidine Alkaloids, in Bad Bug Book, United States Food and Drug Administration.
- ^ (EN) R. Schoental and J. S. Kelly, Liver lesions in young rats suckled by mothers treated with the pyrrolizidine (Senecio) alkaloids, lasiocarpine and retrorsine, in The Journal of Pathology and Bacteriology, vol. 2, n. 77, 1959 April, pp. 485-495, PMID 13642195.
- ^ (EN) Paul M. Ridker and William V. Mcdermott, Comfrey Herb Tea and Hepatic Veno-Occlusive Disease, in The Lancet, vol. 333, n. 8639, 1989, pp. 657-658, DOI:10.1016/S0140-6736(89)92154-5.
- ^ a b (EN) Yeong M.L., et al., Hepatic veno-occlusive disease associated with comfrey ingestion, in Journal of Gastroenterology and Hepatology, vol. 5, n. 2, 1990, pp. 211-214, DOI:10.1111/j.1440-1746.1990.tb01827.x, PMID 2103401.
- ^ (EN) Felix Stickel and Helmut K Seitz, The efficacy and safety of comfrey, in Public Health Nutrition, vol. 3, 4a, 2007, DOI:10.1017/S1368980000000586.
- ^ (EN) R. Schoental, Toxicology and carcinogenic action of pyrrolizidine alkaloids, in Cancer Res, vol. 28, n. 11, novembre 1968, pp. 2237-46, PMID 4302035. PDF.
- ^ (EN) K. M. Larson, M. R. Roby, and F. R. Stermitz, Unsaturated Pyrrolizidines from Borage (Borago officinalis), a Common Garden Herb, in Journal of Natural Products, vol. 47, n. 4, 1984, pp. 747-748, DOI:10.1021/np50034a045.
- ^ (EN) D. A. Pass, G. G. Hogg, R. G. Russell, J. A. Edgar, I. M. Tence, L. Rikard-Bell, Poisoning of Chickens and Ducks by Pyrrolizidine Alkaloids of Heliotropium europaeum, in Australian Veterinary Journal, vol. 55, n. 6, 1979, pp. 284-288, DOI:10.1111/j.1751-0813.1979.tb14711.x.
- ^ (EN) A. R. Mattocks, Minor alkaloids of Heliotropium indicum L, in Journal of the Chemical Society C: Organic, 1967, pp. 329-331, DOI:10.1039/j39670000329.
- ^ (EN) João Sammy N. Souza et al., Pyrrolizidine alkaloids from Heliotropium indicum, in Journal of the Brazilian Chemical Society, vol. 16, 6b, 2005, pp. 1410-1414, DOI:10.1590/S0103-50532005000800019.
- ^ (EN) C. C. J. Culvenor, J. A. Edgar, L. W. Smith, Pyrrolizidine alkaloids in honey from Echium plantagineum L, in Journal of Agricultural and Food Chemistry, vol. 29, n. 5, 1981, pp. 958-960, DOI:10.1021/jf00107a018.
- ^ (EN) H. Wiedenfeld and A. Andrade-Cetto, Pyrrolizidine alkaloids from Ageratum houstonianum Mill., in Phytochemistry, vol. 57, n. 8, 2001, pp. 1269-1271, DOI:10.1016/S0031-9422(01)00192-3, PMID 11454357.
- ^ (EN) L. Joosten, P. P. J. Mulder, K. Vrieling, J. A. van Veen, P. G. L. Klinkhamer, The analysis of pyrrolizidine alkaloids in Jacobaea vulgaris; a comparison of extraction and detection methods, in Phytochemical Analysis, 2009, pp. n/a–n/a, DOI:10.1002/pca.1183.
- ^ (EN) H. Wiedenfeld, Plants containing pyrrolizidine alkaloids: toxicity and problems, in Food Additives & Contaminants: Part A, vol. 28, n. 3, 2011, pp. 282-292, DOI:10.1080/19440049.2010.541288.
- ^ (EN) Adelheid Ehmke , Kirsten Borstel, and Thomas Hartmann, Alkaloid N-oxides as transport and vacuolar storage compounds of pyrrolizidine alkaloids in Senecio vulgaris L, in Planta, vol. 176, n. 1, 1988, pp. 83-90, DOI:10.1007/BF00392483.
- ^ (EN) T. Hartmann, A. Ehmke, U. Eilert, K. Borstel, and C. Theuring, Sites of synthesis, translocation and accumulation of pyrrolizidine alkaloid N-oxides in Senecio vulgaris L., in Planta, vol. 177, n. 1, 1989, pp. 98-107, DOI:10.1007/BF00392159. PDF.
- ^ (EN) Adams, I. Roger; Hamlin, K. E., Jr.; Jelinek, C. F.; Phillips, R. F., Structure of riddelliine, the alkaloid in Senecio riddellii, in Journal of the American Chemical Society, vol. 64, n. 12, 1942, pp. 2760-2763, DOI:10.1021/ja01264a013.
- ^ (EN) Fu, P.P., Yang, Y.C., Xia, Q., Chou, M.C., Cui, Y.Y., Lin G., Pyrrolizidine alkaloids-tumorigenic components in Chinese herbal medicines and dietary supplements, in Journal of Food and Drug Analysis, vol. 10, n. 4, 2002, pp. 198-211.
Bibliografia
[modifica | modifica wikitesto]- (EN) A. R. Mattocks and I. N. H. White, Pyrrolic Metabolites from Non-toxic Pyrrolizidine Alkaloids, in Nature, vol. 231, 1971, pp. 114-115, DOI:10.1038/newbio231114a0.
- (DE) Helmut Wiedenfeld e Erhard Röder, Pyrrolizidinalkaloide. Struktur und Toxizität (PDF), in Deutsche Apotheker-Zeitung, n. 124, 1984, pp. 2116-2122. URL consultato il 5 febbraio 2018 (archiviato dall'url originale il 22 dicembre 2012).
- (EN) D. J. Robins, Pyrrolizidine alkaloids, in Natural Product Reports, vol. 3, 1986, p. 297, DOI:10.1039/np9860300297.
- (EN) David J. Robins, Biosynthesis of pyrrolizidine alkaloids, in Chemical Society Reviews, vol. 18, 1989, pp. 375-408, DOI:10.1039/cs9891800375.
- (EN) F. Böttcher, D. Ober e Thomas Hartmann, Biosynthesis of pyrrolizidine alkaloids: putrescine and spermidine are essential substrates of enzymatic homospermidine formation, in Canadian Journal of Chemistry, vol. 72, n. 1, 1994, pp. 80-85, DOI:10.1139/v94-013.
- (EN) E. Roeder, Medicinal plants in Europe containing pyrrolizidine alkaloids, in Pharmazie, vol. 50, n. 2, febbraio 1995, pp. 83-98, PMID 7700976.
- (EN) R. Lindigkeit, A. Biller, M. Buch, H.-M. Schiebel, M. Boppre e T. Hartmann, The two Faces of Pyrrolizidine Alkaloids: the Role of the Tertiary Amine and its N-Oxide in Chemical Defense of Insects with Acquired Plant Alkaloids, in European Journal of Biochemistry, vol. 245, n. 3, 1997, pp. 626-636, DOI:10.1111/j.1432-1033.1997.00626.x.
- (EN) Dietrich Ober and Thomas Hartmann, Homospermidine synthase, the first pathway-specific enzyme of pyrrolizidine alkaloid biosynthesis, evolved from deoxyhypusine synthase, in Proceedings of the National Academy of Sciences, vol. 96, n. 26, 1999, pp. 14777-14782, DOI:10.1073/pnas.96.26.14777.
- (EN) Ryan J. Huxtable and Roland A. Cooper, Pyrrolizidine Alkaloids: Physicochemical Correlates of Metabolism and Toxicity, vol. 745, 1999, pp. 100-117, DOI:10.1021/bk-2000-0745.ch007.
- (EN) Thomas Hartmann and Dietrich Ober, Biosynthesis and Metabolism of Pyrrolizidine Alkaloids in Plants and Specialized Insect Herbivores, vol. 209, 2000, pp. 207-243, DOI:10.1007/3-540-48146-X_5.
- (EN) Peter P. Fu, Qingsu Xia, Ge Lin e Ming W. Chou, Pyrrolizidine Alkaloids - Genotoxicity, Metabolism Enzymes, Metabolic Activation, and Mechanisms [collegamento interrotto], in Drug Metabolism Reviews, vol. 36, n. 1, 2004, pp. 1-55. PDF
- (EN) Dorothee Langel, Dietrich Ober e Pieter B. Pelser, The evolution of pyrrolizidine alkaloid biosynthesis and diversity in the Senecioneae, in Phytochemistry Reviews, vol. 10, n. 1, 2010, pp. 3-74, DOI:10.1007/s11101-010-9184-y. Free PDF[collegamento interrotto]
- (EN) EFSA Panel on Contaminants in the Food Chain (CONTAM), Scientific Opinion on Pyrrolizidine alkaloids in food and feed, in EFSA Journal, vol. 9, n. 11, 2011, p. 2406, DOI:10.2903/j.efsa.2011.2406.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Alcaloide pirrolizidinico
Wikimedia Commons contiene immagini o altri file su Alcaloide pirrolizidinico
Collegamenti esterni
[modifica | modifica wikitesto]- L'EFSA valuta l'impatto sulla salute causato dagli alcaloidi pirrolizidinici negli alimenti e nei mangimi, su efsa.europa.eu, Autorità europea per la sicurezza alimentare (EFSA), 8 novembre 2011. URL consultato il 20 ottobre 2012.
- Parere scientifico relativo agli alcaloidi pirrolizidinici negli alimenti per l'uomo e per gli animali (sintesi), su europass.parma.it, Autorità europea per la sicurezza alimentare (EFSA), 8 novembre 2011. URL consultato il 20 ottobre 2012 (archiviato dall'url originale il 29 novembre 2011).
- (EN) Environmental Health Criteria 80 - Pyrrolizidine Alkaloids, su inchem.org, IPCS INCHEM, 1988. URL consultato il 20 ottobre 2012.