Aciloine

Le aciloine sono una classe di composti organici che possiedono un gruppo ossidrilico in posizione α di un carbonile.
Proprietà[modifica | modifica wikitesto]

Le aciloine sono stabilizzate da un legame idrogeno intramolecolare tra l'idrogeno della funzione idrossilica e l'ossigeno del carbonile.
Sintesi[modifica | modifica wikitesto]
La sintesi delle aciloine viene classicamente effettuata attraverso le seguenti reazioni:
- la condensazione aciloinica, un accoppiamento riduttivo degli esteri;
- la condensazione benzoinica, una reazione di condensazione tra aldeidi catalizzata da un nucleofilo;
- l'ossidazione di un carbonile con una molecola di ossigeno, questa reazione non è selettiva;
- ossidazione del corrispondente etere silil-enolico con acido meta-cloroperossibenzoico (ossidazione di Rubottom);
- ossidazione MoOPH di un carbonile, con l'utilizzo di perossido di molibdeno, piridina e esametilfosforammide.
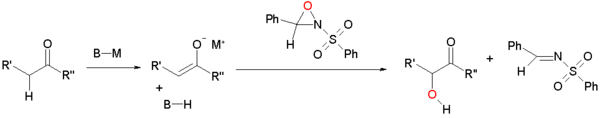
Ossidazione dell'enolato da parte di solfonilossaziridine[modifica | modifica wikitesto]
Gli enolati possono essere ossidati dalle solfonilossaziridine.[1][2] L'enolato reagisce tramite sostituzione nucleofila all'ossigeno elettrondeficiente dell'anello di ossaziridina.
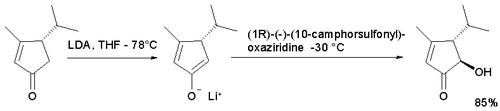
Questo tipo di reazione è modificata in modo da ottenere una sintesi asimmetrica utilizzando ossaziridine chirali derivate dalla canfora. Ciascun isomero dà un accesso esclusivo a uno dei due enantiomeri possibili. Questa modifica è applicata nella sintesi totale del taxolo di Holton.[3][4]
Nell'ossidazione dell'enolato del ciclopentaenone,[5] mostrata sotto, con entrambi gli enantiomeri della canfora si ottiene l'isomero trans in quanto l'accesso per il gruppo idrossilico nella posizione cis è limitato. L'utilizzo dell'ossaziridina standard non permette di sintetizzare una aciloina.
Reazioni[modifica | modifica wikitesto]
- La riduzione delle aciloine produce dioli.
- L'ossidazione delle aciloine produce dioni.
- Alcune aciloine danno un riarrangiamento con uno scambio di posizioni, in un mezzo basico, nella trasformazione di Lobry de Bruyn-van Ekenstein.
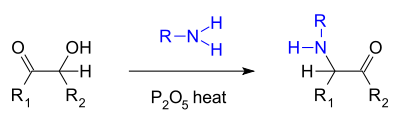
- Una reazione simile è la cosiddetta amminazione di Voight[6] dove una aciloina reagisce con una ammina primaria e anidride fosforica producendo una alfa-chetoammina.[7]
- Sintesi dell'indolo,[8] confrontare con la sintesi di Bischler-Möhlau.
Note[modifica | modifica wikitesto]
- ^ Synthesis of .alpha.-hydroxycarbonyl compounds (acyloins): direct oxidation of enolates using 2 sulfonyloxaziridines Franklin A. Davis, Lal C. Vishwakarma, Joanne G. Billmers, John Finn, J. Org. Chem.; 1984; 49(17); 3241-3243 DOI: 10.1021/jo00191a048
- ^ Asymmetric Oxidation of Ester and Amide Enolates Using New (Camphorylsulfony1)oxaziridines Davis, F. A.; Haque, M. S.; Ulatowski, T. G.; Towson, J. C., J. Org. Chem.; 1986, 51, 2402 DOI: 10.1021/jo00362a053
- ^ Robert A. Holton, Carmen Somoza, Hyeong Baik Kim, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, Hossain Nadizadeh, Yukio Suzuki, Chunlin Tao, Phong Vu, Suhan Tang, Pingsheng Zhang, Krishna K. Murthi, Lisa N. Gentile, and Jyanwei H. Liu, First total synthesis of taxol. 1. Functionalization of the B ring, in J. Am. Chem. Soc., vol. 116, n. 4, 1994, pp. 1597–1598, DOI:10.1021/ja00083a066.
- ^ Robert A. Holton, Hyeong-Baik Kim, Carmen Somoza, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, Hossain Nadizadeh, Yukio Suzuki, Chunlin Tao, Phong Vu, Suhan Tang, Pingsheng Zhang, Krishna K. Murthi, Lisa N. Gentile, and Jyanwei H. Liu, First Total Synthesis of Taxol. 2. Completion of the C and D Rings, in J. Am. Chem. Soc., vol. 116, n. 4, 1994, pp. 1599–1600, DOI:10.1021/ja00083a067.
- ^ An Electrochemical Approach to the Guanacastepenes Chambers C. Hughes, Aubry K. Miller, Dirk Trauner, Organic Letters, 2005 Vol. 7, No. 16 3425-3428 DOI: 10.1021/ol047387l
- ^ E. von Meyer, Karl Voigt, Ueber die Einwirkung von primären aromatischen Aminen auf Benzoïn, in Journal für Praktische Chemie, vol. 34, 1886, pp. 1–27, DOI:10.1002/prac.18860340101.
- ^ Amines: Synthesis, Properties and Applications Stephen A. Lawrence 2004 Cambridge University Press ISBN 0-521-78284-8
- ^ Dr. H. J. Roth, P. Lepke, Synthese von Indol- und Carbazol-Derivaten aus α-Hydroxyketonen und aromatischen Aminen, in Archiv der Pharmazie, vol. 305, n. 3, 1972, pp. 159-171, DOI:10.1002/ardp.19723050302.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Aciloine
Wikimedia Commons contiene immagini o altri file su Aciloine
| Controllo di autorità | GND (DE) 4141355-6 |
|---|