Trasposizione allilica: differenze tra le versioni
m +wikilink |
m Bot: niente spazi dopo l'apostrofo |
||
| Riga 17: | Riga 17: | ||
:[[Image:Lawton reaction.png|400px|Lawton reaction]] |
:[[Image:Lawton reaction.png|400px|Lawton reaction]] |
||
Nel primo passo di questa macrociclizazione il gruppo tiolo in un'estremità del 1,5-pentanoditiolo reagisce con la coda del butadiene in 1 all' |
Nel primo passo di questa macrociclizazione il gruppo tiolo in un'estremità del 1,5-pentanoditiolo reagisce con la coda del butadiene in 1 all'enone 2 in un riarrangiamento allilico, con un solfone gruppo uscente che reagisce ulteriormente con l'altra estremità in una reazione di addizione coniugata. |
||
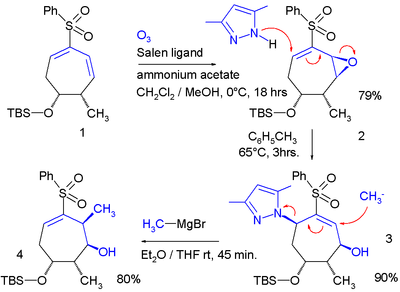
In uno studio<ref>''Double Lawton SN2'Addition to Epoxyvinyl Sulfones: Selective Construction of the Stereotetrads of Aplyronine'' A Ahmad El-Awa and Philip Fuchs [[Org. Lett.]]; '''2006'''; 8(14) pp 2905 - 2908; (Letter) {{DOI|10.1021/ol060530l}}</ref> lo spostamento allilico è stato applicato due volte in un sistema ad anello: |
In uno studio<ref>''Double Lawton SN2'Addition to Epoxyvinyl Sulfones: Selective Construction of the Stereotetrads of Aplyronine'' A Ahmad El-Awa and Philip Fuchs [[Org. Lett.]]; '''2006'''; 8(14) pp 2905 - 2908; (Letter) {{DOI|10.1021/ol060530l}}</ref> lo spostamento allilico è stato applicato due volte in un sistema ad anello: |
||
Versione delle 03:19, 20 set 2017
Il riarrangiamento allilico o trasposizione allilica è una reazione organica nella quale il doppio legame in un composto allilico si trasferisca all'atomo di carbonio successivo. Questo fenomeno si è rilevato nella sostituzione nucleofila.
Nelle condizioni di reazione in cui sia favorito il meccanismo SN1, lo stadio intermedio è un carbocatione, ciò comporta molte possibili strutture di risonanza. Questo spiega la distribuzione del prodotto (product spread) dopo la ricombinazione con il nucleofilo Y. Questo processo è chiamato sostituzione SN1'.
In alternativa è possibile che il nucleofilo attacchi direttamente la posizione allilica, spostando il gruppo uscente in unico passaggio nel processo chiamato sostituzione SN2'. Questo processo si può verificare nella maggior parte dei casi quando l'allile è libero ed è usato un forte nucleofilo. Dalla reazione di 1-cloro-2-butene con idrossido di sodio si ottiene una miscela di 2-buten-1-olo e 1-buten-3-olo:
In un meccanismo di reazione il nucleofilo attacca non direttamente al sito dove si trova l'elettrofilo ma in una addizione coniugata sul doppio legame:
Scopi
L'utilità della sintesi può essere estesa a sostituzioni sui legami del butandiene[1]:
Nel primo passo di questa macrociclizazione il gruppo tiolo in un'estremità del 1,5-pentanoditiolo reagisce con la coda del butadiene in 1 all'enone 2 in un riarrangiamento allilico, con un solfone gruppo uscente che reagisce ulteriormente con l'altra estremità in una reazione di addizione coniugata.
In uno studio[2] lo spostamento allilico è stato applicato due volte in un sistema ad anello:
In questa sequenza di reazione tramite l'epossidazione di Jacobson viene aggiunto un gruppo epossidico ad un diene che fungerà da gruppo uscente nella reazione con il pirazolo nucleofilo. Il secondo nucleofilo è il bromuro di metilmagnesio che determinerà l'espulsione del gruppo pirazolo.
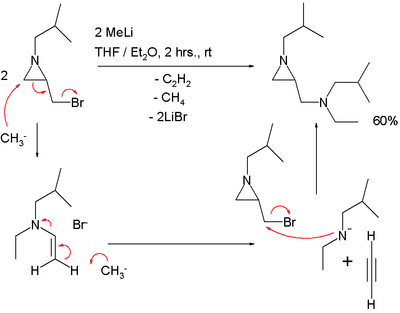
Una reazione SN2' dovrebbe spiegare l'esito della reazione di un aziridina che trasporta un gruppo di bromuro di metilene con metillitio:
In questa reazione viene perso un equivalente dell'acetilene.
Riduzione SN2'
In un adattamento chiamato riduzione SN2' una riduzione organica formale su un gruppo allile contenente un buon gruppo uscente è accompagnata da un riarrangiamento. Un esempio di tale reazione si trova come parte della sintesi totale del Taxolo (anello C):
Trasposizione allilica elettrofila
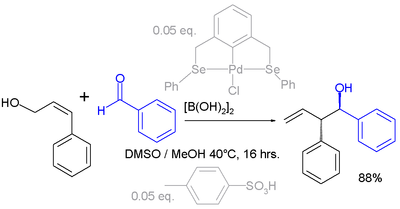
La trasposizione allilica può anche avvenire per via elettrofila. Nell'esempio riportato di seguito il carbonile nel benzaldeide viene attivato dall'acido diboronico prima della reazione con l'alcool allilico (vedi: reazione di Prins):[3][4]
Note
- ^ Molecular yardsticks. Synthesis of extended equilibrium transfer alkylating cross-link reagents and their use in the formation of macrocyclesStephen J. Brocchini, Martin Eberle, and Richard G. Lawton J. Am. Chem. Soc.; 1988; 110(15) pp 5211 - 5212; DOI: 10.1021/ja00223a061
- ^ Double Lawton SN2'Addition to Epoxyvinyl Sulfones: Selective Construction of the Stereotetrads of Aplyronine A Ahmad El-Awa and Philip Fuchs Org. Lett.; 2006; 8(14) pp 2905 - 2908; (Letter) DOI: 10.1021/ol060530l
- ^ Highly Selective and Robust Palladium-Catalyzed Carbon-Carbon Coupling between Allyl Alcohols and Aldehydes via Transient Allylboronic Acids Nicklas Selander, Sara Sebelius, Cesar Estay, Kálmán J. Szabó European Journal of Organic Chemistry Volume 2006, Issue 18 , Pages 4085 - 4087 DOI: 10.1002/ejoc.200600530
- ^ The active catalyst system in this reaction is a combination of a pincer compound and p-toluenesulfonic acid, the reaction product is obtained as a single regioisomer and stereoisomer