Cloruro cianurico
Il cloruro cianurico, noto anche come tricloro triazina,è un composto organico di formula (NCCl)3. Questo solido bianco è la versione clorurata della 1,3,5-triazina, e
| Cloruro cianurico | |
|---|---|
 | |
| Nome IUPAC | |
| 2,4,6-tricloro-1,3,5-triazina | |
| Nomi alternativi | |
| Tricloro triazina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3Cl3N3 |
| Massa molecolare (u) | 184,40 g/mol |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 203-614-9 |
| PubChem | 7954 |
| SMILES | C1(=NC(=NC(=N1)Cl)Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,32 g/mL |
| Temperatura di fusione | 145-148 °C |
| Temperatura di ebollizione | 192 °C |
| Sistema cristallino | monoclino |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 485 mg/kg (orale su topi) |
| Indicazioni di sicurezza | |
| Punto di fiamma | >200 °C |
| Simboli di rischio chimico | |
| Frasi H | 302 - 314 - 317 - 330 - 335 |
| Consigli P | 260 - 280 - 284 - 303+361+353 - 304+340+310 - 305+351+338 [1] |
rappresenta il trimero stabile del cloruro di cianogeno.[2] Esso è anche il precursore principale del discusso ma diffuso erbicida atrazina.
Produzione[modifica | modifica wikitesto]
Viene preparato in due step dall'acido cianidrico usando come intermedio il cloruro di cianogeno, il quale viene trimerizzato ad alte temperature su un catalizzatore a base di carbonio:
Nel 2005 ne sono state prodotte circa 200 000 tonnellate.[3]
Applicazioni industriali[modifica | modifica wikitesto]
Si stima che il 70% del cloruro cianurico venga utilizzato nella preparazione dei pesticidi della classe delle triazine, soprattutto l'atrazina. Tali reazioni si basano sullo spostamento del cloruro con nucleofili, quali ad esempio le ammine:
- (ClCN)3 + 2 RNH2 → (RNHCN)(ClCN)2 + RNH3+Cl−
Altri erbicidi triazinici, come la simazina, l'anilazina e la ciromazina sono prodotti in modo analogo.[4]
Viene usato anche come un precursore di coloranti e agenti di reticolazione nei polimeri. La più grande classe di questi coloranti sono i brillantanti ottici triazinici-stilbene solfonati (OBA) o agenti sbiancanti fluorescenti (FWA) che si trovano comunemente nelle formule detergenti e nella carta bianca. Molti altri coloranti incorporano un anello triazinico, e sono fabbricati anche mediante la reazione di spostamento del cloruro sopra indicata.[4][5]
Usi in sintesi organica[modifica | modifica wikitesto]
Viene utilizzato per convertire alcol e acidi carbossilici in, rispettivamente, cloruri alchilici ed acilici:[6]
Se scaldato in presenza di DMF produce il "reattivo di Gold" Me2NCH=NCH=NMe2+Cl−, il quale è una fonte versatile per le alchilazioni all'azoto e come precursore di composti eterociclici.[7][8]
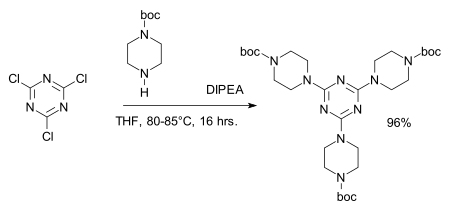
I cloruri sono facilmente sostituiti da nucleofili come gli alcol, in modo da reagire in situ col cloruro acilico formatosi dando un estere, o con le ammine a dare derivati melamminici, per esempio nella sintesi di dendrimeri:[9]
- Viene anche utilizzato come alternativa all'ossalil cloruro nella ossidazione di Swern.[10]
Note[modifica | modifica wikitesto]
- ^ Sigma Aldrich; https://www.sigmaaldrich.com/catalog/product/aldrich/c95501?lang=it®ion=IT
- ^ Cyanuric chloride at Chemicalland21.com
- ^ (EN) Klaus Huthmacher e Dieter Most, Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, 1º gennaio 2000, DOI:10.1002/14356007.a08_191, ISBN 9783527306732. URL consultato il 19 marzo 2017.
- ^ a b Ashford's Dictionary of Industrial Chemicals, 3rd edition, 2011, pages 2495-8
- ^ (EN) Horst Tappe, Walter Helmling e Peter Mischke, Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, 1º gennaio 2000, DOI:10.1002/14356007.a22_651, ISBN 9783527306732. URL consultato il 19 marzo 2017.
- ^ (EN) K. Venkataraman e D.R. Wagle, Cyanuric chloride : a useful reagent for converting carboxylic acids into chlorides, esters, amides and peptides, in Tetrahedron Letters, vol. 20, n. 32, pp. 3037–3040, DOI:10.1016/s0040-4039(00)71006-9. URL consultato il 19 marzo 2017.
- ^ (EN) Donald A. Probst, Paul R. Hanson e David A. Barda, Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, Ltd, 1º gennaio 2001, DOI:10.1002/047084289x.rn00320, ISBN 9780470842898. URL consultato il 19 marzo 2017.
- ^ John T. Gupton; Steven A. Andrews, β-dimethylaminomethylation: N,N-dimethyl-N'-p- tolylformamidine, in Organic Syntheses, vol. 64, 1986, DOI:10.15227/orgsyn.064.0085. URL consultato il 19 marzo 2017.
- ^ Abdellatif Chouai e Eric E. Simanek, Kilogram-scale synthesis of a second-generation dendrimer based on 1,3,5-triazine using green and industrially compatible methods with a single chromatographic step, in The Journal of Organic Chemistry, vol. 73, n. 6, 21 marzo 2008, pp. 2357–2366, DOI:10.1021/jo702462t. URL consultato il 19 marzo 2017.
- ^ Lidia De Luca, Giampaolo Giacomelli e Andrea Porcheddu, A Mild and Efficient Alternative to the Classical Swern Oxidation, in The Journal of Organic Chemistry, vol. 66, n. 23, 1º novembre 2001, pp. 7907–7909, DOI:10.1021/jo015935s. URL consultato il 19 marzo 2017.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su cloruro cianurico
Wikimedia Commons contiene immagini o altri file su cloruro cianurico


