Utente:LauraFrizzi/Sandbox2
| Tossicità dell'ossigeno | |
|---|---|
 | |
| Specialità | Medicina d'emergenza-urgenza |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | 987.8 |
| ICD-10 | T59.8 |
| MeSH | D018496 |
La tossicità dell’ossigeno sul corpo umano è una condizione conseguente agli effetti nocivi della respirazione dell’ossigeno molecolare (O2) ad alte pressioni parziali. È conosciuta anche come sindrome di tossicità da ossigeno, intossicazione da ossigeno o avvelenamento da ossigeno. La tossicità dell’ossigeno sul sistema nervoso centrale, “tossicità CNS”, è conosciuta anche come “effetto Paul Bert”, mentre la tossicità polmonare come “effetto Lorrain Smith”, dal nome dei ricercatori che alla fine del XIX secolo, le scoprirono e le descrissero per primi. La tossicità dell’ossigeno sul corpo umano nei casi più gravi può provocare il danneggiamento o la morte delle cellule, con effetti maggiormente osservabili sul sistema nervoso centrale, sui polmoni e sugli occhi. Ne sono interessati direttamente i subacquei, le persone sottoposte ad alte concentrazioni di ossigeno supplementare (per esempio i neonati prematuri), e quelle sottoposte a terapia iperbarica. La respirazione di ossigeno ad alte pressioni parziali provoca iperossia, ossia una concentrazione eccessiva di ossigeno nei tessuti corporei. I danni provocati sul corpo umano dipendono dal tipo di esposizione ad ossigeno ad alte pressioni parziali. La tossicità CNS è causata da un’esposizione breve all’ossigeno molecolare a pressioni parziali che superano nettamente quella atmosferica. La tossicità polmonare, invece, deriva da un’esposizione prolungata a livelli sempre maggiori di ossigeno ma a pressione normale. Tra i sintomi si annoverano disorientamento, problemi respiratori e alterazioni della vista come la miopia. L’esposizione prolungata ad ossigeno a pressioni parziali leggermente superiori a quella normale, o brevi esposizioni a pressioni parziali molto elevate, possono provocare danni ossidativi alle membrane cellulari, collasso degli alveoli polmonari, distacco della retina e/o convulsioni. La tossicità dell’ossigeno può essere gestita riducendo l’esposizione quando il livello di ossigeno aumenta. Alcuni studi hanno mostrato che, a lungo termine, è possibile un buon recupero dalla maggior parte delle intossicazioni da ossigeno. Esistono dei protocolli per evitare gli effetti dell’iperossia nei campi in cui avviene la respirazione di ossigeno a pressioni parziali superiori a quella normale, come nelle immersioni subacquee durante la quali vengono respirati gas compressi, nella medicina iperbarica, nella medicina neonatale e nelle missioni spaziali. Questi protocolli hanno portato ad una diminuzione di attacchi epilettici dovuti ad intossicazione da ossigeno, e una limitazione dei danni ai polmoni e agli occhi nei neonati prematuri. Negli ultimi anni, l’ossigeno è stato reso disponibile negli “oxygen bars”, stabilimenti che vendono ossigeno per uso ricreativo. Il US Food and Drug Administration ha avvertito coloro che soffrono di problemi al cuore o di patologie ai polmoni, di prestare attenzione nell'usufruire dei servizi degli "oxygen bars". I subacquei che respirano gas contenenti fino al 100% di ossigeno, dovrebbero ricevere una formazione specifica.
Classificazione[modifica | modifica wikitesto]
Gli effetti della tossicità dell’ossigeno si possono classificare in base all’organo colpito in tre forme principali:[2][3][4]
- Sistema nervoso centrale, si osservano convulsioni seguite da perdita di coscienza, che si verificano in condizioni iperbariche;
- Polmoni, si osserva difficoltà respiratoria e dolore al petto, espressione diretta della respirazione di ossigeno a pressioni sempre maggiori per un lungo periodo;
- Occhi, si osservano alterazioni della vista, in seguito alla respirazione di ossigeno a pressioni crescenti per un periodo prolungato;
La tossicità dell’ossigeno sul sistema nervoso centrale causa attacchi epilettici, brevi periodi di rigidità seguiti da convulsioni e perdita di coscienza e riguarda principalmente i subacquei che fanno uso di ossigeno a pressioni parziali superiori a quella atmosferica. La tossicità polmonare provoca danni ai polmoni, che comportano dolore e difficoltà respiratoria, mentre danni ossidativi agli occhi possono portare alla miopia o al parziale distacco della retina. I danni agli occhi e ai polmoni si verificano principalmente quando viene somministrato dell’ossigeno supplementare come parte di un trattamento, per esempio ai neonati prematuri, ma anche durante terapia iperbarica. I danni ossidativi possono interessare qualsiasi cellula del corpo, ma agli effetti sui tre organi più suscettibili (cervello, polmoni e occhi) sono rivolte le maggiori attenzioni. La tossicità dell’ossigeno può provocare anche danni ai globuli rossi(emolisi),[5][6],al fegato[7], al cuore[8], alle ghiandole endocrine (ghiandole surrenali, gonadi e tiroide),[9][10][11] ai reni[12] e danni alle cellule in generale.[13][14] In circostanze insolite, può darsi che vengano provocati degli effetti in altri tessuti del corpo: si presume, per esempio, che durante le spedizioni spaziali, le alte concentrazioni di ossigeno possano contribuire al danneggiamento osseo.[15] L’iperossia può causare indirettamente, in pazienti con malattie polmonari come ostruzioni croniche o depressione respiratoria centrale, narcosi da anidride carbonica.[15] L’iperventilazione in condizioni normali non provoca intossicazione da ossigeno, perché l’aria a livello del mare ha una pressione parziale dell’ossigeno di 0,21 bar (21kPa), mentre la tossicità dell’ossigeno si verifica solo a pressioni superiori ai 0,3 bar (30kPa).[16]
Sintomi[modifica | modifica wikitesto]
| Esposizione (min.) | Num. di soggetti | Sintomi |
|---|---|---|
| 96 | 1 | Accecamento prolungato; Grave emetismo spasmodico |
| 60–69 | 3 | Grave tremore alle labbra; Euforia; Nausea e vertigini; Tremore al braccio |
| 50–55 | 4 | Grave tremore alle labbra; Accecamento temporaneo; Addormentamento; Stordimento |
| 31–35 | 4 | Nausea, vertigini, tremore alle labbra; Convulsioni |
| 21–30 | 6 | Convulsioni; Sonnolenza; Grave tremore alle labbra; Aura epigastrica; Tremore al braccio sinistro; Amnesia |
| 16–20 | 8 | Convulsioni; Vertigini e grave tremore alle labbra; Aura epigastrica; Respirazione spasmodica; |
| 11–15 | 4 | Dispnea espiratoria; tremore alle labbra e sincope; Nausea e stato confusionale |
| 6–10 | 6 | Temporaneo accecamento e tremore alle labbra; Parestesia; Vertigini; "Spasmo diaframmatico"; Grave nausea |
Sistema nervoso centrale[modifica | modifica wikitesto]
La tossicità CNS si manifesta con sintomi come l’alterazione della vista (soprattutto della “visione a tunnel”), ronzii (acufene), nausea, spasmi (specialmente sul viso), cambiamenti comportamentali (irritabilità, ansia, confusione) e vertigini. Questi possono essere seguiti da crisi tonico-cloniche costituite da due fasi: una prima fase di intensa contrazione muscolare per parecchi secondi (fase tonica), seguita da rapidi spasmi muscolari (fase clonica). La crisi epilettica termina con un periodo di incoscienza (la fase anti-clonica).[17][18] L’insorgenza di crisi epilettiche dipende dalla pressione parziale dell’ossigeno respirato e dalla durata dell’esposizione. Il tempo di esposizione prima dell’insorgenza di crisi epilettiche è però imprevedibile, poiché i test hanno mostrato una grande variazione, sia tra diversi individui, sia nello stesso individuo da un giorno all’altro.[17][19][20] Molti fattori esterni, come le immersioni subacquee, l’esposizione al freddo e l’esercizio fisico possono ridurre il tempo entro il quale si manifestano sintomi sul sistema nervoso centrale.[1] La diminuzione della tolleranza è strettamente collegata alla ritenzione dell’anidride carbonica.[21][22][23] Secondo alcuni test condotti sugli animali, alcuni fattori come il buio e la caffeina, aumentano la tolleranza, ma questi effetti non sono stati provati sull’uomo.[24][25]
Polmoni[modifica | modifica wikitesto]
I sintomi della tossicità polmonare si manifestano inizialmente con un’infiammazione alle vie aeree che poi si diffonde ai polmoni (albero tracheobronchiale) e compaiono nella regione superiore del torace (retrosternale e regione carenale).[26][27][28] Il tutto inizia come un lieve solletico nell’inalazione e continua come tosse frequente.[26] Se la respirazione ad alte pressioni parziali continua, i pazienti avvertono un lieve bruciore durante l’inalazione insieme a una tosse insistente e incontrollabile e mancanza occasionale di respiro (dispnea).[26] Dati raccolti relativamente la tossicità polmonare hanno evidenziato anche la presenza di gorgoglii auscultabili attraverso stetoscopio.[28] Un esame ai raggi X dei polmoni mostra piccoli cambiamenti in seguito a una breve esposizione, ma la presenza di un’ombreggiatura diffusa in entrambi i polmoni in seguito ad esposizioni più lunghe.[26] La funzionalità dei polmoni, se misurata, risulta ridotta, come mostrato dalla riduzione della quantità di aria che essi sono capaci di immagazzinare (capacità vitale) e dai cambiamenti nell’espirazione dell’aria e nell'elasticità dei polmoni.[28][29] Test condotti sugli animali hanno evidenziato una variazione nella tolleranza simile a quella trovata nella tossicità CNS, ma allo stesso tempo una significativa variazione tra specie. Quando l’esposizione all’ossigeno a pressione superiore a 0,5 bar (50kPa) è intermittente, i polmoni hanno il tempo di recuperare e di conseguenza viene ritardata l’insorgenza dei sintomi da tossicità.[30]
Occhi[modifica | modifica wikitesto]
Nei neonati prematuri, segni di danni agli occhi (retinopatia del prematuro, o ROP) si osservano tramite un oftalmoscopio e appaiono come una demarcazione tra regioni vascolarizzate e non vascolarizzazione della retina del neonato. Il grado di questa demarcazione determina quattro stadi: (I) la demarcazione è una linea; (II) la demarcazione diventa un crinale; (III) crescita di nuovi vasi sanguigni lungo tutto il crinale; (IV) la retina comincia a staccarsi dalla parente interna dell’occhio (coroide).[31]
Cause[modifica | modifica wikitesto]
Tossicità CNS[modifica | modifica wikitesto]
La tossicità CNS è causata da esposizioni, da alcuni minuti a poche ore, a ossigeno a pressioni parziali superiori a 1,6 bar (160 kPa), circa otto volte la normale pressione parziale atmosferica, che è più probabile si verifichi in pazienti sottoposti a terapia iperbarica o nei subacquei. Dal momento che la pressione atmosferica al livello del mare è di circa 1 bar (100 kPa), la tossicità CNS può verificarsi solamente in condizioni iperbariche.[32][33] I subacquei che respirano a profondità superiori ai 60 m, incontrano un crescente rischio di intossicazione da ossigeno; quelli che respirano una miscela di gas arricchita con ossigeno, come il Nitrox, possono allo stesso modo soffrirne se dovessero scendere al di sotto della massima profondità operativa consentita per quella miscela.[34]
Tossicità polmonare[modifica | modifica wikitesto]
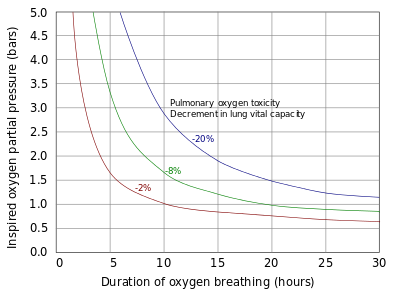
I polmoni e il resto del tratto respiratorio, sono esposti alle più alte concentrazioni di ossigeno del corpo umano e sono quindi i primi organi a manifestare l’intossicazione da ossigeno. La tossicità polmonare si verifica in seguito all’esposizione a ossigeno a pressioni parziali superiori a 0,5 bar (50 kPa), corrispondente a una frazione d’ossigeno del 50% a pressione atmosferica normale. I primi segni della tossicità polmonare sono tracheobronchite, o infiammazione delle vie respiratore superiori, dopo un periodo asintomatico tra le 4 e le 22 ore a frazione inspirata di ossigeno superiore al 95%,[35] con alcuni studi che sostengono che i sintomi si presentino dopo circa 14 ore a questo livello di ossigeno.[36]
A pressioni parziali di ossigeno da 2 a 3 bar (da 200 a 300 kPa), questi sintomi possono iniziare a verificarsi dopo solo 3 ore di esposizione all’ossigeno.[35] Esperimenti sui topi che respiravano ossigeno a pressioni tra 1 e 3 bar (100 e 300 kPa) indicano che le manifestazioni dalla tossicità polmonare potrebbero non essere le stesse nelle condizioni normobariche come lo sono per quelle iperbariche.[37] Diminuzioni delle funzionalità polmonari, possono verificarsi dopo solo 24 ore di continua esposizione a ossigeno al 100%,[36] con danni agli alveoli polmonari; dopo le 48 ore di esposizione a ossigeno al 100% si verifica l'insorgenza di un’acuta sindrome da distress respiratorio.[35] La respirazione di ossigeno al 100%, può portare inoltre al collasso degli alveoli (atelettasia); quando invece vi è una presenza significativa nella miscela di gas inerti quali l'azoto, questi danni non si verificano.[38]
I neonati pretermine, esposti per periodi prolungati ad alte concentrazioni di ossigeno, sono soggetti ad un rischio maggiore di displasia broncopolmonare.[39] Altri gruppi di persone esposte ad un alto rischio di intossicazione da ossigeno, sono i pazienti sottoposti a ventilazione meccanica con ossigeno a concentrazione superiore al 50% e i pazienti esposti a sostanze chimiche che aumentano il rischio di tossicità dell’ossigeno come l’agente chemioterapico bleomicina.[36] Proprio per questo motivo, le attuali linee guida per i pazienti sottoposti a ventilazione meccanica in terapia intensiva raccomandano di mantenere la concentrazione dell’ossigeno inferiore al 60%.[35] Allo stesso modo, i subacquei che si sottopongono ad un trattamento per la cura della malattia da decompressione sono ad alto rischio di tossicità dell’ossigeno, poiché esso comporta la respirazione di ossigeno in condizioni iperbariche per lunghi periodi, che si aggiunge all’esposizione ad ossigeno precedentemente avvenuta durante l’immersione.[32]
Tossicità oculare[modifica | modifica wikitesto]
L’esposizione prolungata ad ossigeno ad alte pressioni parziali causa danni alla retina.[40][41][42] I danni allo sviluppo dell’occhio nei neonati esposti ad alte concentrazioni di ossigeno a pressione normale, segue un meccanismo e ha un effetto diverso dai danni agli occhi osservati nei subacquei adulti sotto condizioni iperbariche.[43][44] L’iperossia può essere un fattore che contribuisce alla fibroplasia retrolenticolare o retinopatia del prematuro (ROP) nei neonati.[43][45] Nei neonati pretermine, la retina è spesso non pienamente vascolarizzata. La retinopatia del prematuro si verifica quando viene arrestato lo sviluppo del sistema vascolare retinico che poi prosegue in modo anomalo con la crescita di nuovi vasi sanguigni, che può essere accompagnata dalla contrazione del tessuto fibroso (tessuto cicatriziale) che causa il distaccamento della retina. L’esposizione ad ossigeno supplementare, nonostante sia un fattore di rischio, non è la causa principale di questa malattia. Per questo limitare l’uso di ossigeno supplementare non riduce necessariamente il tasso di retinopatia del prematuro, anzi può aumentare il rischio di complicanze sistemiche collegate all’ipossia.[43] La miopia dovuta all’iperossia si verifica nei rebreather a circuito chiuso dei subacquei in seguito ad un’esposizione prolungata.[44][46][47] Si verifica frequentemente anche in coloro che sono sottoposti ripetitivamente a terapia iperbarica.[41][48] La miopia è dovuta ad un aumento del potere di rifrazione del cristallino, ma generalmente è reversibile con il tempo.[48][49][49] It is usually reversible with time.[41][48]
Meccanismo[modifica | modifica wikitesto]

La base biochimica che spiega la tossicità dell’ossigeno è la parziale riduzione dell’ossigeno causata dall’allontanamento di uno o due elettroni; questo porta alla formazione di specie di ossigeno reattive,[50] che sono sottoprodotti naturali del normale metabolismo dell’ossigeno e hanno un ruolo importante nella comunicazione cellulare.[51] Una specie prodotta dal corpo, l’anione superossido (O2-),[52] è coinvolto nell’acquisizione del ferro.[53] Concentrazioni di ossigeno superiori a quella normale portano ad un aumento dei livelli di specie di ossigeno reattive.[54] L’ossigeno è necessario per il metabolismo cellulare ed il sangue lo fornisce a tutte le parti del corpo. Quando l’ossigeno viene respirato a pressioni parziali più elevate, si instaura una condizione di iperossia, specialmente nei tessuti più vascolarizzati che risultano essere quindi i più vulnerabili. Durante i periodi di stress ambientale, i livelli di specie reattive dell’ossigeno possono aumentare drammaticamente e questo può danneggiare la struttura delle cellule e produrre stress ossidativo.[20][55] I meccanismi di reazione di queste specie reattive con il corpo umano non sono ancora molto conosciuti.[56] Uno dei più comuni prodotti dello stress ossidativo è il radicale ossidrile (•OH), che può innescare una reazione a catena che danneggia la perossidazione lipidica dei grassi insaturi all’interno delle membrane cellulari.[57] Alte concentrazioni di ossigeno possono aumentare la formazione di radicali liberi, come ossido nitrico, perossinitrito e peroxone, che danneggiano il DNA e altre biomolecole.[20][58] Anche se il corpo umano ha molti sistemi antiossidanti, come il glutatione, che protegge dallo stress ossidativo, essi vengono sopraffatti da alte concentrazioni di ossigeno libero perché il tasso di cellule danneggiate supera la capacità del sistema di ripararle o di prevenirne il danneggiamento. Il risultato è il danneggiamento o la morte della cellula.[59][60][61][62]
Diagnosi[modifica | modifica wikitesto]
La diagnosi di tossicità CNS nei subacquei prima della crisi è difficile in quanto i sintomi che la caratterizzano, ossia disturbo della vista, problemi alle orecchie, vertigini, stato confusionale e nausea, possono essere dovuti a tanti altri fattori tipici dell’ambiente subacqueo come la narcosi, la congestione e il freddo. Tuttavia, la presenza di questi sintomi può aiutare nel diagnosticare la tossicità dell’ossigeno nei primi stadi nei pazienti sottoposti a terapia iperbarica. In entrambi i casi, a meno che non ci sia una storia precedente di epilessia o esami indicanti ipoglicemia, una crisi che si verifica in un ambiente in cui si respira ossigeno a pressioni parziali superiori a 1,4 bar (140 kPa), porta alla diagnosi di tossicità dell’ossigeno.[63]
La diagnosi di displasia broncopolmonare nei neonati con difficoltà respiratorie è difficile nelle prime settimane. Tuttavia, se la respirazione del bambino non migliora durante questo periodo, esami del sangue e raggi X possono essere utilizzati per confermare la displasia broncopolmonare. Inoltre, un elettrocardiogramma può aiutare a escludere altre possibili cause come cardiopatie congenite o ipertensione (arteriosa) polmonare.[64]
La diagnosi di retinopatia del prematuro nei neonati è suggerita dal contesto clinico. L’essere nato prematuro, il basso peso alla nascita e una storia di esposizione all’ossigeno ne sono i principali indicatori, mentre non sono stati individuati fattori ereditari che possano essere causa di questa malattia.[65]
Note[modifica | modifica wikitesto]
- ^ a b c Donald, Part I 1947
- ^ Clark & Thom 2003, pp. 358–360
- ^ (EN) Chris Acott, Oxygen toxicity: A brief history of oxygen in diving, in South Pacific Underwater Medicine Society Journal, vol. 29, n. 3, 1999, pp. 150–5, ISSN 0813-1988, OCLC 16986801. URL consultato il 29 aprile 2008.
- ^ (EN) CC Beehler, Oxygen and the eye, in Survey of Ophthalmology, vol. 45, 1964, pp. 549–60, PMID 14232720.
- ^ (EN) JR Goldstein e CE Mengel, Hemolysis in mice exposed to varying levels of hyperoxia, in Aerospace Medicine, vol. 40, n. 1, 1969, pp. 12–13, PMID 5782651.
- ^ (EN) EC Larkin, JD Adams, WT Williams e DM Duncan, Hematologic responses to hypobaric hyperoxia, in American Journal of Physiology, vol. 223, n. 2, 1972, pp. 431–7, PMID 4403030.
- ^ (EN) Fenton Schaffner e Philip Felig, CHANGES IN HEPATIC STRUCTURE IN RATS PRODUCED BY BREATHING PURE OXYGEN (PDF), in Journal of Cell Biology, vol. 27, n. 3, 1965, pp. 505–17, DOI:10.1083/jcb.27.3.505, PMC 2106769, PMID 5885427.
- ^ (EN) JB Caulfield, RW Shelton e JF Burke, Cytotoxic effects of oxygen on striated muscle, in Archives of Pathology, vol. 94, n. 2, 1972, pp. 127–32, PMID 5046798.
- ^ (EN) JW Bean e PC Johnson, Adrenocortical response to single and repeated exposure to oxygen at high pressure, in American Journal of Physiology, vol. 179, n. 3, 1954, pp. 410–4, PMID 13228600.
- ^ (EN) JE Edstrom e H Rockert, The effect of oxygen at high pressure on the histology of the central nervous system and sympathetic and endocrine cells, in Acta Physiologica Scandinavica, vol. 55, 2–3, 1962, pp. 255–63, DOI:10.1111/j.1748-1716.1962.tb02438.x, PMID 13889254.
- ^ (EN) I Gersh e CE Wagner, Metabolic factors in oxygen poisoning, in American Journal of Physiology, vol. 144, n. 2, 1945, pp. 270–7.
- ^ (EN) RT Hess e DB Menzel, Effect of dietary antioxidant level and oxygen exposure on the fine structure of the proximal convoluted tubules, in Aerospace Medicine, vol. 42, n. 6, 1971, pp. 646–9, PMID 5155150.
- ^ Clark & Thom 2003, pp. 358–360
- ^ (EN) John M Clark, The toxicity of oxygen, in American Review of Respiratory Disease, vol. 110, 6 Pt 2, 1974, pp. 40–50, PMID 4613232.
- ^ a b (EN) Dharmeshkumar N Patel, Ashish Goel, SB Agarwal, Praveenkumar Garg e Krishna K Lakhani, Oxygen toxicity (PDF), in Journal, Indian Academy of Clinical Medicine, vol. 4, n. 3, 2003, pp. 234–237. URL consultato il 28 settembre 2008.
- ^ Clark & Lambertsen 1970, p. 159
- ^ a b Clark & Thom 2003, p. 376
- ^ U.S. Navy Diving Manual 2011
- ^ U.S. Navy Diving Manual 2011, p. 22
- ^ a b c N Bitterman, CNS oxygen toxicity, in Undersea and Hyperbaric Medicine, vol. 31, n. 1, 2004, pp. 63–72, PMID 15233161. URL consultato il 29 aprile 2008.
- ^ Lang 2001, p. 82
- ^ (EN) Drew Richardson, Michael Menduno e Karl Shreeves (a cura di), Proceedings of rebreather forum 2.0, in Diving Science and Technology Workshop, 1996, pp. 286. URL consultato il 20 settembre 2008.
- ^ (EN) Drew Richardson e Karl Shreeves, The PADI enriched air diver course and DSAT oxygen exposure limits, in South Pacific Underwater Medicine Society Journal, vol. 26, n. 3, 1996, ISSN 0813-1988, OCLC 16986801. URL consultato il 2 maggio 2008.
- ^ (EN) N Bitterman, Y Melamed e I Perlman, CNS oxygen toxicity in the rat: role of ambient illumination, in Undersea Biomedical Research, vol. 13, n. 1, 1986, pp. 19–25, PMID 3705247. URL consultato il 20 settembre 2008.
- ^ (EN) N Bitterman e S Schaal, Caffeine attenuates CNS oxygen toxicity in rats, in Brain Research, vol. 696, 1–2, 1995, pp. 250–3, DOI:10.1016/0006-8993(95)00820-G, PMID 8574677.
- ^ a b c d Clark & Thom 2003, p. 383
- ^ (EN) John M Clark e Christian J Lambertsen, Pulmonary oxygen toxicity: a review, in Pharmacological Reviews, vol. 23, n. 2, 1971, pp. 37–133, PMID 4948324.
- ^ a b c John M Clark e Christian J Lambertsen, Rate of development of pulmonary O2 toxicity in man during O2 breathing at 2.0 Ata, in Journal of Applied Physiology, vol. 30, n. 5, 1971, pp. 739–52, PMID 4929472.
- ^ Clark & Thom 2003, pp. 386–387
- ^ (EN) J Lorrain Smith, The pathological effects due to increase of oxygen tension in the air breathed (PDF), in Journal of Physiology, vol. 24, n. 1, London, The Physiological Society and Blackwell Publishing, 1899, pp. 19–35, PMC 1516623, PMID 16992479.
- ^ (EN) Alistair R Fielder, The Management of Visual Impairment in Childhood, a cura di Alistair R Fielder, Anthony Best e Martin C O Bax, London, Mac Keith Press : Distributed by Cambridge University Press, 1993, p. 33, ISBN 0-521-45150-7.
- ^ a b (EN) RW Smerz, Incidence of oxygen toxicity during the treatment of dysbarism, in Undersea and Hyperbaric Medicine, vol. 31, n. 2, 2004, pp. 199–202, PMID 15485081. URL consultato il 30 aprile 2008.
- ^ (EN) Neal B Hampson, Steven G Simonson, CC Kramer e Claude A Piantadosi, Central nervous system oxygen toxicity during hyperbaric treatment of patients with carbon monoxide poisoning, in Undersea and Hyperbaric Medicine, vol. 23, n. 4, 1996, pp. 215–9, PMID 8989851. URL consultato il 29 aprile 2008.
- ^ Lang 2001, p. 7
- ^ a b c d (EN) H Bitterman, Bench-to-bedside review: Oxygen as a drug, in Critical Care, vol. 13, n. 1, 2009, pp. 205, DOI:10.1186/cc7151, PMC 2688103, PMID 19291278.
- ^ a b c (EN) RM Jackson, Pulmonary oxygen toxicity, in Chest, vol. 88, n. 6, 1985, pp. 900–905, DOI:10.1378/chest.88.6.900, PMID 3905287.
- ^ (EN) Ivan T Demchenko, Karen E Welty-Wolf, Barry W Allen e Claude A Piantadosi, Similar but not the same: normobaric and hyperbaric pulmonary oxygen toxicity, the role of nitric oxide, in American Journal of Physiology. Lung Cellular and Molecular Physiology, vol. 293, n. 1, 2007, pp. L229–38, DOI:10.1152/ajplung.00450.2006, PMID 17416738.
- ^ M Wittner e RM Rosenbaum, Pathophysiology of pulmonary oxygen toxicity, Proceedings of the Third International Conference on Hyperbaric Medicine, NAS/NRC, 1404, Washington DC, 1966, pp. 179–88.– e altri come trattato da Clark & Lambertsen 1970, pp. 256–60
- ^ (EN) Eduardo Bancalari, Nelson Claure e Ilene RS Sosenko, Bronchopulmonary dysplasia: changes in pathogenesis, epidemiology and definition, in Seminars in Neonatology, vol. 8, n. 1, London, Elsevier Science, 2003, pp. 63–71, DOI:10.1016/S1084-2756(02)00192-6, PMID 12667831.
- ^ (EN) OD Yarbrough, W Welham, ES Brinton e Alfred R Behnke, Symptoms of Oxygen Poisoning and Limits of Tolerance at Rest and at Work, in Nedu-47-01, United States Navy Experimental Diving Unit Technical Report, 1947. URL consultato il 29 aprile 2008.
- ^ a b c (EN) B Anderson e Joseph C Farmer, Hyperoxic myopia, in Transactions of the American Ophthalmological Society, vol. 76, 1978, pp. 116–24, PMC 1311617, PMID 754368.
- ^ (EN) B Ricci, D Lepore, M Iossa, A Santo, M D'Urso e N Maggiano, Effect of light on oxygen-induced retinopathy in the rat model. Light and OIR in the rat, in Documenta Ophthalmologica, vol. 74, n. 4, 1990, pp. 287–301, DOI:10.1007/BF00145813, PMID 1701697.
- ^ a b c (EN) AV Drack, Preventing blindness in premature infants, in New England Journal of Medicine, vol. 338, n. 22, 1998, pp. 1620–1, DOI:10.1056/NEJM199805283382210, PMID 9603802.
- ^ a b (EN) Frank K Butler, E White e M Twa, Hyperoxic myopia in a closed-circuit mixed-gas scuba diver, in Undersea and Hyperbaric Medicine, vol. 26, n. 1, 1999, pp. 41–5, PMID 10353183. URL consultato il 29 aprile 2009.
- ^ (EN) CW Nichols e Christian Lambertsen, Effects of high oxygen pressures on the eye, in New England Journal of Medicine, vol. 281, n. 1, 1969, pp. 25–30, DOI:10.1056/NEJM196907032810106, PMID 4891642.
- ^ (EN) Barbara E Shykoff, Repeated Six-Hour Dives 1.35 ATM Oxygen Partial Pressure, in Nedu-Tr-05-20, Panama City, FL, USA, US Naval Experimental Diving Unit Technical Report, 2005. URL consultato il 19 settembre 2008.
- ^ (EN) Barbara E Shykoff, Pulmonary effects of submerged oxygen breathing in resting divers: repeated exposures to 140 kPa, in Undersea and Hyperbaric Medicine, vol. 35, n. 2, 2008, pp. 131–43, PMID 18500077.
- ^ a b c B Anderson Jr e DL Shelton, Axial length in hyperoxic myopia, in In: Bove, Alfred A; Bachrach, Arthur J; Greenbaum, Leon (eds.) Ninth International Symposium of the UHMS, Undersea and Hyperbaric Medical Society, 1987, pp. 607–11.
- ^ a b (HE) S Schaal, I Beiran, I Rubinstein, B Miller e A Dovrat, Oxygen effect on ocular lens, in Harefuah, vol. 144, n. 11, 2005, pp. 777–780, 822, PMID 16358652.
- ^ Clark & Thom 2003, p. 360
- ^ (EN) SG Rhee, Cell signaling. H2O2, a necessary evil for cell signaling, in Science, vol. 312, n. 5782, 2006, pp. 1882–1883, DOI:10.1126/science.1130481, PMID 16809515.
- ^ (EN) Steven R Thom, Inert gas enhancement of superoxide radical production, in Archives of Biochemistry and Biophysics, vol. 295, n. 2, 1992, pp. 391–6, DOI:10.1016/0003-9861(92)90532-2, PMID 1316738.
- ^ (EN) Andrew J Ghio, Eva Nozik-Grayck, Jennifer Turi, Ilona Jaspers, Danielle R Mercatante, Ryszard Kole e Claude A Piantadosi, Superoxide-dependent iron uptake: a new role for anion exchange protein 2, in American Journal of Respiratory Cell and Molecular Biology, vol. 29, n. 6, 2003, pp. 653–60, DOI:10.1165/rcmb.2003-0070OC, PMID 12791678.
- ^ (EN) I Fridovich, Oxygen toxicity: a radical explanation (PDF), in Journal of Experimental Biology, vol. 201, n. 8, 1998, pp. 1203–9, PMID 9510531.
- ^ (EN) Claude A Piantadosi, Carbon Monoxide, Reactive Oxygen Signaling, and Oxidative Stress, in Free Radical Biology & Medicine, vol. 45, n. 5, 2008, pp. 562–9, DOI:10.1016/j.freeradbiomed.2008.05.013, PMC 2570053, PMID 18549826.
- ^ (EN) JA Imlay, Pathways of oxidative damage, in Annual Review of Microbiology, vol. 57, 2003, pp. 395–418, DOI:10.1146/annurev.micro.57.030502.090938, PMID 14527285.
- ^ (EN) R Bowen, Free Radicals and Reactive Oxygen, su vivo.colostate.edu, Colorado State University. URL consultato il 26 settembre 2008.
- ^ TD Oury, YS Ho, Claude A Piantadosi e JD Crapo, Extracellular superoxide dismutase, nitric oxide, and central nervous system O2 toxicity (PDF), in Proceedings of the National Academy of Sciences of the United States of America, vol. 89, n. 20, 1992, pp. 9715–9, Bibcode:1992PNAS...89.9715O, DOI:10.1073/pnas.89.20.9715, PMC 50203, PMID 1329105.
- ^ (EN) Steven R Thom e RE Marquis, Free radical reactions and the inhibitory and lethal actions of high-pressure gases, in Undersea Biomedical Research, vol. 14, n. 6, 1987, pp. 485–501, PMID 2825395. URL consultato il 26 settembre 2008.
- ^ R Djurhuus, AM Svardal e E Thorsen, Glutathione in the cellular defense of human lung cells exposed to hyperoxia and high pressure, in Undersea and Hyperbaric Medicine, vol. 26, n. 2, 1999, pp. 75–85, PMID 10372426. URL consultato il 26 Settebre 2008.
- ^ (EN) John J Freiberger, Kathy Coulombe, Hagir Suliman, Martha-sue Carraway e Claude A Piantadosi, Superoxide dismutase responds to hyperoxia in rat hippocampus, in Undersea and Hyperbaric Medicine, vol. 31, n. 2, 2004, pp. 227–32, PMID 15485085. URL consultato il 26 settembre 2008.
- ^ (EN) YS Kim e SU Kim, Oligodendroglial cell death induced by oxygen radicals and its protection by catalase, in Journal of Neuroscience Research, vol. 29, n. 1, 1991, pp. 100–6, DOI:10.1002/jnr.490290111, PMID 1886163.
- ^ (EN) NBDHMT, Recommended Guidelines for Clinical Internship in Hyperbaric Technology (V: C.D), su nbdhmt.org, Harvey, LA, National Board of Diving and Hyperbaric Medical Technology, 4 febbraio 2009. URL consultato il 26 marzo 2009 (archiviato dall'url originale il 20 settembre 2007).
- ^ (EN) How is bronchopulmonary dysplasia diagnosed?, su nhlbi.nih.gov, U.S. Department of Health & Human Services. URL consultato il 28 settembre 2008.
- ^ Regillo, Brown & Flynn 1998, p. 178
Bibliografia[modifica | modifica wikitesto]
- (EN) James M Clark e Stephen R Thom, Oxygen under pressure, in Bennett and Elliott's physiology and medicine of diving, 5ª ed., United States, Saunders, 2003, pp. 358–418, ISBN 978-0-7020-2571-6, OCLC 51607923.
- (EN) John M Clark e Christian J Lambertsen, Pulmonary oxygen tolerance in man and derivation of pulmonary oxygen tolerance curves, in IFEM Report No. 1-70, Philadelphia PA, Environmental Biomedical Stress Data Center, Institute for Environmental Medicine, University of Pennsylvania Medical Center, 1970. URL consultato il 29 aprile 2008.
- (EN) Kenneth W Donald, Oxygen Poisoning in Man: Part I, in British Medical Journal, vol. 1, n. 4506, 1947, pp. 667–672, DOI:10.1136/bmj.1.4506.667, PMC 2053251, PMID 20248086.
- (EN) Kenneth W Donald, Oxygen Poisoning in Man: Part II, in British Medical Journal, vol. 1, n. 4507, 1947, pp. 712–717, DOI:10.1136/bmj.1.4507.712, PMC 2053400, PMID 20248096.
- Versione rivista degli articoli di Donald anche disponibile come:
- (EN) Kenneth W Donald, Oxygen and the diver, UK, Harley Swan, 1992, ISBN 1-85421-176-5, OCLC 26894235.
- (EN) Robert W Hamilton e Edward D Thalmann, Decompression practice, in Alf O Brubakk e Tom S Neuman (a cura di), Bennett and Elliott's physiology and medicine of diving, 5ª ed., United States, Saunders, 2003, pp. 475–479, ISBN 978-0-7020-2571-6, OCLC 51607923.
- (EN) Michael A Lang, DAN nitrox workshop proceedings, Durham NC, Divers Alert Network, 2001. URL consultato il 20 settembre 2008.
- (EN) Carl D Regillo, Gary C Brown e Harry W Flynn, Vitreoretinal Disease: The Essentials, New York, Thieme, 1998, ISBN 978-0-86577-761-3, OCLC 39170393.
- (EN) U.S. Navy Supervisor of Diving, U.S. Navy Diving Manual (PDF), U.S. Naval Sea Systems Command, 2011. URL consultato il 29 gennaio 2015.
Approfondimenti[modifica | modifica wikitesto]
- (EN) John S. Lamb, The Practice of Oxygen Measurement for Divers, Flagstaff, Best Publishing, 120 pages, 1999, ISBN 0-941332-68-3, OCLC 44018369.
- (EN) Lippmann, John e Bugg, Stan, The Diving Emergency Handbook, Teddington, UK, Underwater World Publications, 1993, ISBN 0-946020-18-3, OCLC 52056845.
- (EN) Lippmann, John e Mitchell, Simon, Oxygen, in 2nd (a cura di), Deeper into Diving, Victoria, Australia, J.L. Publications, 2005, pp. 121–4, ISBN 0-9752290-1-X, OCLC 66524750.