Tolvaptan
| Tolvaptan | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| N-(4-{[(5R*)-7-cloro-5-idrossi-2,3,4,5-tetraidro-1H-1-benzazepin-1-yl]carbonil}-3-metilfenil)-2-metilbenzamide | |
| Nomi alternativi | |
| OPC-41061 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C26H25ClN2O3 |
| Massa molecolare (u) | 448.941 g/mol |
| Numero CAS | |
| Numero EINECS | 691-537-5 |
| Codice ATC | C03 |
| PubChem | 216237 |
| SMILES | CC1=CC=CC=C1C(=O)NC2=CC(=C(C=C2)C(=O)N3CCCC(C4=C3C=CC(=C4)Cl)O)C |
| Dati farmacocinetici | |
| Biodisponibilità | sconosciuta |
| Legame proteico | 99% |
| Metabolismo | Epatico (CYP3A4-mediato)[1] |
| Emivita | 12 ore |
| Indicazioni di sicurezza | |
Il tolvaptan è un farmaco che agisce come antagonista competitivo, selettivo, dei recettori V2 della vasopressina, usato per il trattamento dell'iponatriemia (riduzione patologica della concentrazione di sodio nel sangue) associata a scompenso cardiaco congestizio o a cirrosi epatica e nella sindrome da inappropriata secrezione di ADH (SIADH). Il tolvaptan è stato approvato negli Stati Uniti d'America dalla Food and Drug Administration il 19 maggio 2009 e in Europa dall'EMA il 3 agosto 2009[2]. Esso è commercializzato dalla Otsuka Pharmaceutical Co. con il nome di Samsca (indicato per la SIADH) e di Jinarc (indicato per la malattia policistica renale dell'adulto).
Viene anche denominato acquaretico[3], come si può leggere
«Tolvaptan, a vasopressin type 2 receptor antagonist, has an aquaretic effect without affecting renal function»
Uso clinico
[modifica | modifica wikitesto]In uno studio del 2004 è stato dimostrato che il tolvaptan, somministrato in associazione a un diuretico tradizionale, aumentava l'escrezione di fluidi in eccesso e migliorava la concentrazione di sodio nel sangue in pazienti con scompenso cardiaco senza effetti avversi come ipotensione (riduzione della pressione arteriosa) o ipokaliemia (riduzione patologica della concentrazione di potassio nel sangue)[4][5].
Il tolvaptan è ora approvato in molti Paesi anche per la malattia policistica renale dell'adulto (ADPKD). I primi studi clinici pubblicati a tal riguardo risalgono ai primi anni 2000[6]. Nel 2015 l'agenzia europea per i medicinali (EMA) ha approvato l'uso di tolvaptan per la malattia policistica[7]. Uno studio pubblicato nel 2012 ha dimostrato che il tolvaptan, somministrato con un dosaggio medio di 95 mg al giorno per almeno tre anni, rispetto al placebo rallenta del 50% l'aumento di volume dei reni affetti dalla malattia. Tale aumento risulta infatti del 2.80% all'anno con il tolvaptan contro il 5.51% all'anno con il placebo, con una elevata significatività statistica (p<0.001)[8].
Sintesi
[modifica | modifica wikitesto]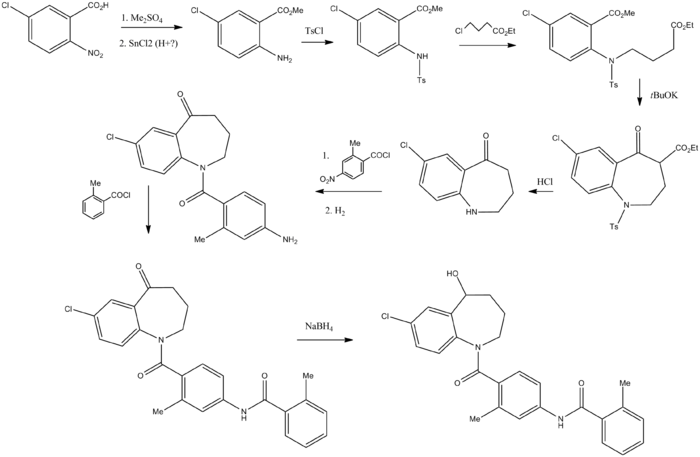
Effetti avversi
[modifica | modifica wikitesto]La FDA, riguardo al farmaco Samsca (tolvaptan), raccomanda di non utilizzarlo per più di 30 giorni e di evitare l'uso in pazienti affetti da malattie epatiche a causa del rischio di tossicità d'organo che può determinare insufficienza epatica.[10]
Stereochemistry
[modifica | modifica wikitesto]Tolvaptan è un racemo, cioè una miscela di 1: 1 dei due enantiomeri seguenti:[11]
| Enantiomeri di Tolvaptan | |
|---|---|
 Numero-CAS: 331947-66-1 |
 Numero-CAS: 331947-44-5 |
Note
[modifica | modifica wikitesto]- ^ Shoaf S, Elizari M, Wang Z, etal, Tolvaptan administration does not affect steady state amiodarone concentrations in patients with cardiac arrhythmias, in J Cardiovasc Pharmacol Ther, vol. 10, n. 3, 2005, pp. 165–71, DOI:10.1177/107424840501000304, PMID 16211205.
- ^ EMA website, su ema.europa.eu. URL consultato il 6 novembre 2015.
- ^ Uemura Y, Shibata R, Takemoto K, Uchikawa T, Koyasu M, et al., Clinical benefit of tolvaptan in patients with acute decompensated heart failure and chronic kidney disease, in Heart Vessels, 28 Nov 2015, PMID 26615607.
- ^ Gheorghiade M, Gattis W, O'Connor C, etal, Effects of tolvaptan, a vasopressin antagonist, in patients hospitalized with worsening heart failure: a randomized controlled trial, in JAMA, vol. 291, n. 16, 2004, pp. 1963–71, DOI:10.1001/jama.291.16.1963, PMID 15113814.
- ^ * Gheorghiade M, Niazi I, Ouyang J, etal, Vasopressin V2-receptor blockade with tolvaptan in patients with chronic heart failure: results from a double-blind, randomized trial, in Circulation, vol. 107, n. 21, 2003, pp. 2690–6, DOI:10.1161/01.CIR.0000070422.41439.04, PMID 12742979.
- ^ Otsuka Maryland Research Institute, Inc.
- ^ Autorizzazione EMA per tolvaptan nella ADPKD (PDF), su ema.europa.eu. URL consultato l'8 novembre 2015.
- ^ (2012) Tolvaptan in Patients with Autosomal Dominant Polycystic Kidney Disease
- ^ K. Kondo, H. Ogawa, H. Yamashita, H. Miyamoto, M. Tanaka, K. Nakaya, K. Kitano, Y. Yamamura, S. Nakamura, T. Onogawa, T. Mori e M. Tominaga, 7-Cloro-5-idrossi-1-[2-metil-4-(2-metilbenzoilamino)benzoil]-2,3,4,5-tetraidro-1H-1-benzazepina (OPC-41061): A potent, orally active nonpeptide arginine vasopressin V2 receptor antagonist, in Bioorganic & Medicinal Chemistry, vol. 7, n. 8, 1999, p. 1743, DOI:10.1016/S0968-0896(99)00101-7.
- ^ "U.S. Food and Drug Administration." Samsca (Tolvaptan): Drug Safety Communication. N.p., 30 Apr. 2013., su fda.gov. URL consultato il 1º giugno 2014..
- ^ Rote Liste Service GmbH (Hrsg.): Rote Liste 2017 - Arzneimittelverzeichnis für Deutschland (einschließlich EU-Zulassungen und bestimmter Medizinprodukte). Rote Liste Service GmbH, Frankfurt/Main, 2017, Aufl. 57, ISBN 978-3-946057-10-9, S. 222.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Tolvaptan
Wikimedia Commons contiene immagini o altri file su Tolvaptan