Permanganato
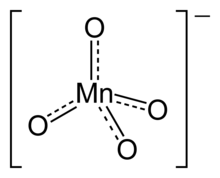

Il permanganato è un ossoanione del manganese di formula MnO−4.
Il manganese ha stato di ossidazione +7 ed è isoelettronico con il cromato. I suoi composti sono forti ossidanti.
Sintesi
[modifica | modifica wikitesto]I permanganati possono essere prodotti per ossidazione dei composti del manganese con forti agenti ossidanti, come ipoclorito, biossido di piombo, bismutato:
oppure, meno efficientemente, per dismutazione dei manganati:
Produzione industriale
[modifica | modifica wikitesto]Viene sintetizzato a partire da minerali contenenti il biossido.
Per arrostimento vengono fatte le prime due ossidazioni: a Mn(V) e Mn(VI). Nel primo stadio si utilizza un impasto di minerale e potassa caustica, a temperature comprese tra 390 °C e 420 °C:
Poi a temperature comprese tra 180 e 330 °C e più lentamente:
L'ultima ossidazione avviene per via elettrochimica.
Reattività
[modifica | modifica wikitesto]È un forte ossidante, similmente al perclorato. Può distruggere completamente i composti organici.
In soluzione acida, il permanganato si riduce all'incolore stato di ossidazione +2 dello ione Mn2+; il potenziale standard di riduzione è pari a E0 = 1,51 V:
In soluzione fortemente basica, il permanganato si riduce allo stato di ossidazione +6, verde, dello ione manganato (MnO2−4).
In ambiente debolmente basico o neutro a diossido di manganese (MnO2) con potenziale standard di riduzione E0 = 1,23 V:
In ambiente di acido fosforico si forma Mn(III).
I permanganati non sono termicamente stabili. Per esempio, il permanganato di potassio si decompone a 230 °C:
Per riduzione con solfito dà ipomanganato (MnO3−4).
Preparazione delle soluzioni
[modifica | modifica wikitesto]Il permanganato reagisce con molte impurezze che possono essere presenti nell'acqua usata per la preparazione della soluzione, in particolare sostanze organiche. Si decompone anche in presenza di biossido solido:
e con Mn2+:
Pertanto le soluzioni preparate di fresco devono essere bollite per un'ora e filtrate su lana di vetro o setto poroso.
Composti
[modifica | modifica wikitesto]Fra i composti più utilizzati:
- Permanganato di potassio (KMnO4)
- Permanganato di sodio (NaMnO4)
Bibliografia
[modifica | modifica wikitesto]- N. N. Greenwood e A. Earnshaw, Chimica degli elementi, II, Piccin, ISBN 88-299-1121-6.
- W. Büchner, R. Schliebs, G. Winter e K.H. Büchel, Chimica inorganica industriale, Piccin, ISBN 88-299-1348-0.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su permanganato
Wikimedia Commons contiene immagini o altri file su permanganato
Collegamenti esterni
[modifica | modifica wikitesto]- permanganato, su sapere.it, De Agostini.
- (EN) National Pollutant Inventory – Manganese and compounds Fact Sheet, su npi.gov.au. URL consultato il 26 giugno 2007 (archiviato dall'url originale il 1º marzo 2006).
| Controllo di autorità | Thesaurus BNCF 37477 |
|---|











