Anticorpi anti-citoplasma dei neutrofili

Gli anticorpi anti-citoplasma dei neutrofili (spesso chiamati ANCA, dall'inglese anti-neutrophil cytoplasmic antibodies), costituiscono un gruppo di autoanticorpi, prevalentemente del tipo IgG, diretti contro antigeni situati nel citoplasma dei granulociti neutrofili (il tipo più numeroso di globuli bianchi) e dei monociti. Si possono rilevare nel siero, mediante un semplice esame del sangue, in molte malattie autoimmuni, ma in particolare sono associati con alcune forme di vasculiti, le cosiddette vasculiti ANCA-associate: granulomatosi di Wegener, poliangioite microscopica e sindrome di Churg-Strauss.[1][2]
Classificazione
[modifica | modifica wikitesto]Gli ANCA si possono suddividere in due classi, chiamate rispettivamente c-ANCA e p-ANCA, in base alla disposizione che assumono legandosi a neutrofili fissati con etanolo e al loro principale antigene bersaglio. Il titolo anticorpale degli ANCA si misura solitamente con metodica ELISA o con l'immunofluorescenza indiretta.[3]
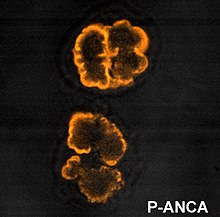
- I p-ANCA si legano alla cellula bersaglio intorno al nucleo (pattern perinucleare). L'antigene contro cui sono diretti è comunemente la mieloperossidasi (MPO).
- I c-ANCA si dispongono sulla cellula secondo un disegno di tipo granulare, diffuso nel citoplasma. L'antigene bersaglio più comune è la proteinasi 3 (PR3).
- Gli ANCA diretti contro antigeni diversi da MPO e PR3 possono, talvolta, assumere un aspetto "a chiazze" all'immunofluorescenza, e sono più comuni nei pazienti con malattie diverse dalle vasculiti, tre quelle associate con la produzione di ANCA.
- Un'ulteriore variante, detta x-ANCA, si può ritrovare nel corso di molte patologie, ma in particolare è frequente nelle malattie infiammatorie croniche intestinali.[4]
Solitamente i c-ANCA si ritrovano nella granulomatosi di Wegener (sono presenti nel 90% dei casi attivi)[5], mentre i p-ANCA sono associati con la poliangioite microscopica, con la glomerulonefrite rapidamente progressiva di tipo necrotizzante[6] e con la sindrome di Churg-Strauss. In particolare, l’80% dei pazienti con malattia di Wegener sviluppa PR3-ANCA e il 15% MPO-ANCA, il 70% di quelli con poliangioite microscopica presenta MPO-ANCA e il 20% PR3-ANCA, mentre nella sindrome di Churg-Strauss compaiono nel 35% MPO-ANCA e nel 5% PR3-ANCA.[7] In molte altre malattie autoimmuni, come la rettocolite ulcerosa e la spondilite anchilosante, è possibile trovare ANCA in circolo. In questi casi, comunque, non vi sono segni di vasculite, tanto che la presenza degli anticorpi è considerata incidentale, un epifenomeno più che una causa della malattia.[8] Gli ANCA possono essere indotti da alcuni farmaci (propiltiouracile, idralazina) e dalla cocaina.
Patogenesi
[modifica | modifica wikitesto]Il processo che porta alla produzione degli ANCA non è completamente conosciuto, sebbene siano state proposte diverse ipotesi. È probabile che esista una predisposizione genetica, verosimilmente legata a geni coinvolti nella regolazione immunitaria, ma con il contributo di fattori ambientali, come vaccinazioni o esposizione ad alcune sostanze (silicati). Tuttavia nessuno dei meccanismi patogenetici proposti finora spiega il motivo delle diverse specificità di questi anticorpi.[9]
Teoria del mimetismo molecolare
[modifica | modifica wikitesto]I superantigeni microbici sono molecole espresse da batteri e altri microorganismi, capaci di stimolare la risposta immune mediante l'attivazione dei linfociti T. Alcune regioni di queste molecole possono presentare similitudini strutturali con molecole proprie dell'organismo ospite, inducendo una risposta immunologica diretta contro queste ultime (autoimmunità). Gli antigeni streptococcici e stafilococcici, ad esempio, sono coinvolti nella genesi di molte malattie autoimmuni: un classico esempio è quello dello steptococco di gruppo A nella cardiopatia reumatica, indotta dalla somiglianza tra l'antigene M dello streptococco e alcune proteine strutturali delle cellule cardiache. È stato dimostrato che fino al 70% dei pazienti affetti da granulomatosi di Wegener è portatore cronico di Staphylococcus aureus a livello nasale e che i portatori hanno un rischio di recidiva otto volte più alto rispetto ai non portatori.[9] La reazione immunitaria conseguente è un'ipersensibilità di secondo tipo.
Teoria dell'apoptosi difettosa
[modifica | modifica wikitesto]L'apoptosi, o morte cellulare programmata, è fondamentale per i neutrofili (così come per molti altri tipi cellulari) per controllare la durata della risposta infiammatoria precoce e ridurre il danno tissutale indotto dagli stessi neutrofili. Gli ANCA potrebbero svilupparsi in seguito a un'apoptosi inefficace o ad una rimozione incompleta dei frammenti cellulari residui dopo l'apoptosi, che esporrebbe al sistema immunitario molecole normalmente sequestrate all'interno della cellula. Questa teorie spiegherebbe come sia possibile la formazione di anticorpi contro antigeni intracellulari, come quelli che costituiscono il bersaglio degli ANCA.[9]
Ruolo patogeno degli ANCA
[modifica | modifica wikitesto]Tre malattie sono particolarmente associate alla presenza degli ANCA nel circolo ematico: la granulomatosi di Wegener, la poliangioite microscopica e la sindrome di Churg-Strauss. Colpendo prevalentemente i piccoli vasi (compresi i capillari glomerulari), tali condizioni patologiche interessano frequentemente il rene.[10] Nel caso della granulomatosi di Wegener è stata dimostrata una correlazione positiva fra il titolo dei PR3-ANCA e l'attività di malattia.
Studi in vitro e studi sperimentali nei topi hanno evidenziato che gli ANCA hanno azione patogena sui neutrofili. I neutrofili sensibilizzati da citochine proinfiammatorie (es. TNFa, IL-1) o prodotti microbici esprimono sulla superficie cellulare sia MPO che PR3. Gli ANCA si legano ai rispettivi antigeni di membrana, come pure ai recettori per il frammento costante delle Ig (Fcγ). Queste interazioni attivano i neutrofili, che secernono i propri granuli e rilasciano enzimi litici, citochine proinfiammatorie, radicali liberi dell’ossigeno, composti attivanti il complemento e neutrophil extracellular traps (NETS); questi elementi causano danno tessutale, provocando un'infiammazione delle pareti del vaso (vasculite), e potenziano la risposta autoimmune.[11][7][12] Inoltre, alcuni studi in vitro hanno evidenziato come gli ANCA reagiscono con le cellule endoteliali che esprimono l'antigene PR3.[9]
Storia
[modifica | modifica wikitesto]Gli ANCA furono descritti per la prima volta da Davies et al. nel 1982 nella glomerulonefrite segmentaria necrotizzante,[13] e da van der Woude et al. nel 1985 nella granulomatosi di Wegener.[14]
Il secondo incontro del gruppo di lavoro internazionale sugli ANCA, tenutosi nei Paesi Bassi nel mese di maggio 1989, ha stabilito la nomenclatura degli anticorpi suddividendoli in perinucleari e citoplasmici, mentre gli antigeni mieloperossidasi e proteinasi 3 sono stati scoperti rispettivamente nel 1988 e nel 1989.[15] Le riunioni del consensus internazionale sono quindi proseguite con cadenza biennale.
Note
[modifica | modifica wikitesto]- ^ Mansi IA, Opran A, Rosner F, ANCA-associated small-vessel vasculitis, in Am Fam Physician, vol. 65, n. 8, aprile 2002, pp. 1615–20, PMID 11989638.
- ^ Ozaki S, ANCA-associated vasculitis: diagnostic and therapeutic strategy, in Allergol Int, vol. 56, n. 2, giugno 2007, pp. 87–96, DOI:10.2332/allergolint.R-07-141, PMID 17460438. URL consultato il 14 dicembre 2011 (archiviato dall'url originale il 27 aprile 2013).
- ^ Radice A & Sinico RA. Antineutrophil cytoplasmic antibodies (ANCA). Autoimmunity, 2005;38(1):93-103. PMID 15804710
- ^ Copia archiviata, su specialtylabs.com. URL consultato il 9 dicembre 2011 (archiviato dall'url originale il 17 novembre 2006).
- ^ Thomas M. Habermann, Mayo Clinic internal medicine review, 2006-2007, CRC Press, 26 giugno 2006, pp. 935–, ISBN 978-0-8493-9059-3. URL consultato il 1º novembre 2010.
- ^ Kain R, Matsui K, Exner M et al. A novel class of autoantigens of anti-neutrophil cytoplasmic antibodies in necrotizing and crescentic glomerulonephritis: the lysosomal membrane glycoprotein h-lamp-2 in neutrophil granulocytes and a related membrane protein in glomerular endothelial cells. J Exp Med, 1995;181(2):585-597. PMID 7836914
- ^ a b (EN) Agata Walulik e et al., The Role of Neutrophils in ANCA-Associated Vasculitis: The Pathogenic Role and Diagnostic Utility of Autoantibodies, in Int J Mol Sci ., vol. 24, 2023, p. 17217, PMID 38139045.
- ^ Seo P & Stone J. The Antineutrophil Cytoplasmic Antibody-Associated Vasculitides. Am J Med, 2004;117:39-50. PMID 15210387
- ^ a b c d Reumaux D, Duthilleul P, Roos D., Pathogenesis of diseases associated with antineutrophil cytoplasm autoantibodies. Hum Immunol, 2004;65(1):1-12. PMID 14700590.
- ^ Bosch X, Guilabert A, Espinosa G, Mirapeix E, Treatment of antineutrophil cytoplasmic antibody associated vasculitis: a systematic review, in JAMA, vol. 298, n. 6, 2007, pp. 655–69, DOI:10.1001/jama.298.6.655, PMID 17684188.
- ^ (EN) Daigo Nakazawa e et al., Pathogenesis and therapeutic interventions for ANCA-associated vasculitis (PDF), in Nat Rev Rheumatol ., vol. 15, 2019, pp. 91-101, PMID 30542206.
- ^ Falk RJ, Terrell RS, Charles LA, Jennette JC. Anti-neutrophil cytoplasmic autoantibodies induce neutrophils to degranulate and produce oxygen radicals in vitro. Proc Natl Acad Sci U S A, 1990;87:4115-4119. PMID 2161532.
- ^ Davies DJ, Moran JE, Niall JF, Ryan GB. Segmental necrotising glomerulonephritis with antineutrophil antibody: possible arbovirus aetiology. Brit Med J, 1982;285:606. PMID 6297657.
- ^ van der Woude FJ, Rasmussen N, Lobatto S et al. Autoantibodies against neutrophils and monocytes: tool for diagnosis and marker of disease activity in Wegener's granulomatosis. Lancet, 1985;1(8426):425-9. PMID 2857806.
- ^ Jennette JC, Hoidal JR, Falk RJ. Specificity of anti-neutrophil cytoplasmic autoantibodies for proteinase 3. Blood, 1990;75:2263-4. PDF (2 MB). PMID 2189509.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su anticorpo anti-citoplasma dei neutrofili
Wikimedia Commons contiene immagini o altri file su anticorpo anti-citoplasma dei neutrofili