Acetato di calcio
| Acetato di calcio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Acetato di calcio | |
| Nomi alternativi | |
| E263 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H6CaO4 |
| Massa molecolare (u) | 158,17 |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 200-540-9 |
| PubChem | 6116 |
| DrugBank | DB00258 |
| SMILES | CC(=O)[O-].CC(=O)[O-].[Ca+2] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,50 |
| Indice di rifrazione | 1,55 |
| Solubilità in acqua | 374 g/l a 0 °C 297 g/l a 100 °C |
| Dati farmacologici | |
| Modalità di somministrazione | orale |
| Dati farmacocinetici | |
| Biodisponibilità | 30-40% |
| Escrezione | escrezione tramite feci |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 75 mg/kg, topo, i.v. 203 mg/kg, topo, i.p. |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
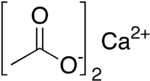
L'acetato di calcio è il sale di calcio dell'acido acetico di formula (CH3COO)2Ca. In condizioni standard appare come un solido cristallino bianco, igroscopico, dal leggero odore di aceto, solubile in acqua e parzialmente in etanolo, insolubile nei solventi organici come acetone e benzene. Viene comunemente commercializzato nella forma monoidrata di formula C4H6CaO4·H2O e numero CAS , meno frequentemente come diidrato di formula C4H6CaO4·2H2O. Trova impiego nell'industria alimentare come additivo ed in medicina come rimedio per l'iperfosfatemia[2].
Sintesi[modifica | modifica wikitesto]
L'acetato di calcio può essere preparato ammorbidendo nell'aceto la calce idrata (idrossido di calcio) o il carbonato di calcio (che si trova nei gusci delle uova o nelle rocce carbonatiche come calcare o marmo).[3]
Reattività[modifica | modifica wikitesto]
La forma monoidrata dell'acetato di calcio risulta essere più stabile sia rispetto alla sostanza anidra che al diidrato. Se riscaldato oltre i 160 °C il composto anidro si decompone dando carbonato di calcio ed acetone:[2]
- (CH3COO)2Ca → CaCO3 + CH3-CO-CH3
Se esposto all'aria, a temperatura ambiente, assorbe umidità atmosferica convertendosi nella forma monoidrata. Il diidrato tende invece a perdere acqua di cristallizzazione se esposto all'aria, convertendosi anch'esso nel monoidrato più stabile[2].
Applicazioni[modifica | modifica wikitesto]
L'acetato di calcio monoidrato viene comunemente utilizzato a livello industriale come anti-schiumogeno, mordente e come stabilizzante e lubrificante plastico, inoltre trova impiego come reagente nella sintesi organica dell'acetaldeide. Viene altresì utilizzato nell'industria alimentare come conservante[2].
Note[modifica | modifica wikitesto]
- ^ Acetato di calcio idrato - scheda di dati di sicurezza (PDF), su sigma-aldrich.com, Sigma-Aldrich. URL consultato il 9 gennaio 2017.
- ^ a b c d (EN) Calcium acetate, su Hazardous Substances Data Bank, National Institutes of Health. URL consultato il 9 gennaio 2017.
- ^ Process for preparing calcium carbonate, 8 settembre 1997. URL consultato il 18 maggio 2018.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su acetato di calcio
Wikimedia Commons contiene immagini o altri file su acetato di calcio

