Reazione elettrociclica
In chimica organica una reazione elettrociclica è un tipo di reazione periciclica dove il risultato finale è la formazione di un legame pi greco e la simultanea scomparsa di un legame sigma, o viceversa.[1] In genere queste reazioni sono categorizzate secondo i seguenti criteri:
- Le reazioni possono essere termiche o fotochimiche.
- Le reazioni possono essere di apertura o di chiusura di anello.
- La reazione può procedere con un meccanismo conrotatorio o disrotatorio, a seconda del tipo di reazione (termica o fotochimica) e del numero di elettroni pi greco coinvolti.
- Il tipo di rotazione determina se il prodotto formato sarà cis o trans.
Esempi classici
[modifica | modifica wikitesto]La reazione di ciclizzazione di Nazarov è una reazione elettrociclica che converte divinilchetoni in ciclopentenoni. Un esempio classico è l'apertura di anello del 3,4-dimetilciclobutene. L'isomero cis forma esclusivamente cis,trans-2,4-esadiene, mentre l'isomero trans dà il diene trans,trans.[2]

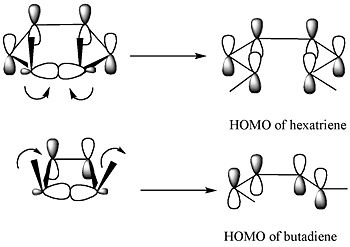
Il decorso della reazione si può spiegare in modo semplice con il metodo degli orbitali di frontiera: il legame sigma del reagente si aprirà in modo che gli orbitali pi risultanti abbiano la stessa simmetria dell'HOMO del prodotto (un butadiene). L'unico modo per ottenere questo risultato è un'apertura conrotatoria dell'anello che forma lobi terminali con segni opposti.

Stereospecificità delle reazioni elettrocicliche
[modifica | modifica wikitesto]Nel condurre una reazione elettrociclica è a volte utile conoscere in anticipo la geometria cis/trans del prodotto di reazione. A questo scopo il primo passo è determinare se la reazione procede in modo conrotatorio o disrotatorio. La tabella seguente mostra le regole di selettività per reazioni elettrocicliche termiche e fotochimiche.
| Sistema | Induzione termica (stato fondamentale) | Induzione fotochimica (stato eccitato) |
|---|---|---|
| Numero pari di coniugazioni | Conrotatorio | Disrotatorio |
| Numero dispari di coniugazioni | Disrotatorio | Conrotatorio |
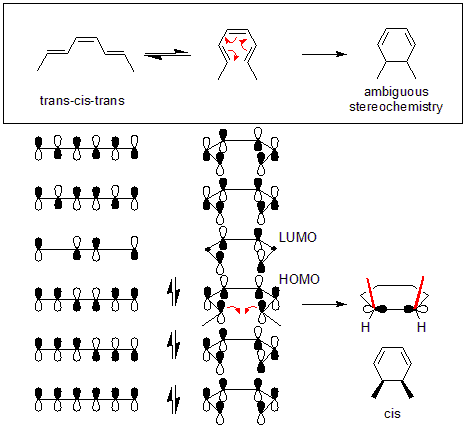
Nell'esempio mostrato di seguito la reazione termica del (trans,cis,trans)-otta-2,4,6-triene avrà luogo con meccanismo disrotatorio. Dopo aver stabilito il tipo di rotazione, si può determinare se il prodotto sarà cis o trans esaminando l'HOMO della molecola di partenza. Nell'esempio sotto il movimento disrotatorio porta i due metili a puntare in alto, facendo sì che il prodotto sia cis-dimetilcicloesadiene.
In una reazione elettrociclica può esistere anche una selettività torsionale che riguarda il senso della rotazione. Ad esempio, in una reazione conrotatoria la rotazione può comunque avvenire in due direzioni, portando a prodotti enantiomerici. In caso di selettività torsionale una delle direzioni di rotazione è favorita (parzialmente o totalmente) portando ad un eccesso enantiomerico del prodotto.
Meccanismo delle reazioni termiche
[modifica | modifica wikitesto]Regole di Woodward-Hoffmann
[modifica | modifica wikitesto]Per i due processi si possono costruire diagrammi di correlazione che collegano gli orbitali molecolari del reagente con quelli del prodotto aventi la stessa simmetria.[3]
Questi diagrammi di correlazione indicano che per il 3,4-dimetilciclobutene è permessa per simmetria solo un'apertura d'anello conrotatoria, mentre per il 5,6-dimetilcicloesa-1,3-diene è permessa per simmetria solo un'apertura d'anello disrotatoria. Solo in questi casi si ottiene infatti un massimo di sovrapposizione degli orbitali nello stato di transizione. Inoltre, il prodotto formato sarebbe nello stato fondamentale anziché in uno stato eccitato.
Teoria degli orbitali di frontiera
[modifica | modifica wikitesto]Secondo questa teoria il legame sigma nell'anello si aprirà in modo che gli orbitali pi risultanti abbiano la stessa simmetria dell'HOMO del prodotto.[4]
Il massimo di sovrapposizione degli orbitali nello stato di transizione si ottiene solo nel modo disrotatorio, dove la simmetria rispetto al piano speculare è conservata durante la reazione. Inoltre, ne risulterebbe la formazione di un prodotto in uno stato eccitato di stabilità confrontabile con lo stato eccitato del reagente.
Reazioni elettrocicliche in sistemi biologici
[modifica | modifica wikitesto]Le reazioni elettrocicliche sono frequenti in natura.[5] Una delle più comuni è la biosintesi della vitamina D3. Nel primo passaggio il 7-deidrocolesterolo subisce una apertura conrotatoria dell'anello per via fotochimica, formando la pre vitamina D3. Segue una trasposizione sigmatropica [1,7] per arrivare alla vitamina D3.[6]
Un altro esempio è la biosintesi proposta per l'aranotina, una ossepina di origine naturale. L'epossidazione enzimatica della dichetopiperazina derivata dalla fenilalanina forma l'arene ossido, che dà luogo ad una reazione di elettrociclizzazione disrotatoria 6π con apertura dell'anello per formare l'ossepina. Dopo una seconda epossidazione dell'anello, il vicino azoto nucleofilo attacca il carbonio elettrofilo formando un anello a cinque termini. L'anello risultante è un sistema ciclico che si trova comunemente nell'aranotina e composti analoghi.
Reazioni elettrocicliche in sintesi organica
[modifica | modifica wikitesto]Una reazione elettrociclica spesso studiata è l'apertura d'anello termica conrotatoria del benzociclobutene. Il prodotto di reazione è un orto-chinodimetano molto instabile, ma questa molecola può essere intrappolata in un'addizione endo con un dienofilo forte come l'anidride maleica per dare l'addotto Diels-Alder. La resa del processo di apertura dell'anello del benzociclobutano (Schema 1) dipende dalla natura del sostituente R.[7] In un solvente come il toluene, alla temperatura di 110 °C la resa cresce da metile a isobutilmetile a trimetilsililmetile. L'aumento di velocità di reazione per il composto trimetilsilile può essere spiegata dalla iperconiugazione del silicio dato che il legame βC-Si dona elettroni al legame C-C del ciclobutano indebolendolo.

Una reazione elettrociclica a cascata biomimetica fu scoperta nell'isolare e sintetizzare alcuni acidi endiandrici:[8][9]

Le reazioni elettrocicliche asimmetriche costituiscono un campo emergente della sintesi organica. Le reazioni più studiate in questo settore sono la sintesi di Staudinger 4π dei β-lattami[10] e la reazione 4π di Nazarov. Per entrambe le reazioni la catalisi asimmetrica è stata controllata usando ausiliari chirali, e la reazione di Nazarov è stata condotta cataliticamente con acidi di Lewis chirali, acidi di Brønsted e ammine chirali.[11]
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- (EN) C. M. Beaudry, J. P. Malerich e D. Trauner, Biosynthetic and Biomimetic Electrocyclizations, in Chem. Rev., vol. 105, n. 12, 2005, pp. 4757-4778, DOI:10.1021/cr0406110.
- (EN) F. P. Cossío, A. Arrieta e M. A. Sierra, The Mechanism of the Ketene−Imine (Staudinger) Reaction in Its Centennial: Still an Unsolved Problem?, in Acc. Chem. Res., vol. 41, n. 8, 2008, pp. 925-936, DOI:10.1021/ar800033j.
- (EN) I. Fleming, Frontier Orbitals and Organic Chemical Reactions, John Wiley & Sons, 1977, ISBN 9780471018209.
- (EN) R. Hoffmann e R. B. Woodward, The conservation of orbital symmetry, in Acc. Chem. Res., vol. 1, n. 1, 1968, pp. 17-22, DOI:10.1021/ar50001a003.
- (EN) Y. Matsuya, N. Ohsawa e H. Nemoto, Accelerated Electrocyclic Ring-Opening of Benzocyclobutenes under the Influence of a β-Silicon Atom, in J. Am. Chem. Soc., vol. 128, n. 2, 2006, pp. 412-413, DOI:10.1021/ja055505+.
- A. D. McNaught e A. Wilkinson, electrocyclic reaction, su IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"), Blackwell Scientific Publications, 2006. URL consultato il 15 febbraio 2017.
- (EN) K. C. Nicolaou, N. A. Petasis e R. E. Zipkin, The endiandric acid cascade. Electrocyclizations in organic synthesis. 4. Biomimetic approach to endiandric acids A-G. Total synthesis and thermal studies, in J. Am. Chem. Soc., vol. 104, n. 20, 1982, pp. 5560-5562, DOI:10.1021/ja00384a080.
- (EN) K. C. Nicolau, Inspirations, Discoveries, and Future Perspectives in Total Synthesis, in J. Org. Chem., vol. 74, n. 3, 2009, pp. 951-972, DOI:10.1021/jo802351b.
- (EN) W. H. Okamura, H. Y. Elnagar, M. Ruther e S. Dobreff, Thermal [1,7]-sigmatropic shift of previtamin D3 to vitamin D3: synthesis and study of pentadeuterio derivatives, in J. Org. Chem., vol. 58, n. 3, 1993, pp. 600-610, DOI:10.1021/jo00055a011.
- (EN) S. Thompson, A. G. Coyne, P. C. Knipe e M. D. Smith, Asymmetric electrocyclic reactions, in Chem. Soc. Rev., vol. 40, 2011, pp. 4217-4231, DOI:10.1039/C1CS15022G.
- (EN) R. E. K. Winter, The preparation and isomerization of cis- and trans-3,4-dimethylcyclobutene, in Tetrahedron Letters, vol. 6, n. 17, 1965, pp. 1207-1212, DOI:10.1016/S0040-4039(01)83997-6.