Selenito
| Selenito | |
|---|---|
 | |
| Nome IUPAC | |
| Selenito[1][2] | |
| Nomi alternativi | |
| Ione selenito | |
| Caratteristiche generali | |
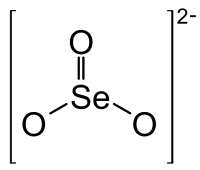
| Formula bruta o molecolare | SeO2−3 |
| Massa molecolare (u) | 126.968[3] |
| Numero CAS | Immagine_3D |
| SMILES | [O-][Se](=O)[O-] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| Frasi H | ---[4] |
| Consigli P | ---[5] |
L'anione selenito è un ossoanione del selenio con formula chimica SeO2−3.I composti detti seleniti sono quelli contenenti questo ione.
In condizioni leggermente acide, si forma lo ione idrogenoselenito, HSeO−3; in condizioni più acide si forma l'acido selenioso, H2SeO3. Vedi Categoria:Seleniti per una lista dei suoi composti.
Struttura[modifica | modifica wikitesto]
Lo ione selenito ha forma piramidale e l'atomo del selenio è il vertice della piramide. Le distanze tra gli atomi di selenio e ossigeno sono di 172 pm. Nella struttura dell'anione selenito, l'atomo del selenio ha un doppietto solitario, che permette allo ione selenito di comportarsi come ligando anche con l'atomo di selenio, oltre che con quello di ossigeno, e ciò si riflette sulle strutture cristalline dei seleniti metallici.[6][7]
Sintesi[modifica | modifica wikitesto]
I seleniti possono essere preparati neutralizzando l'acido selenioso con ossidi metallici o idrossidi. La maggior parte dei seleniti salini può essere formata riscaldando il relativo ossido di metallo con diossido di selenio, per esempio:[6][8][9][10]
- Na2O + SeO2 → Na2SeO3.
I seleniti sono utilizzati tra l'altro nei fertilizzanti e il selenito di sodio, selenito di bario nella fabbricazione del vetro.
Note[modifica | modifica wikitesto]
- ^ Nomenclature of Inorganic Chemistry : IUPAC Recommendations 2005 (Red Book), Cambridge, The Royal Society of Chemistry, 2005, ISBN 978-0-85404-438-2.
- ^ (EN) PubChem Compound, CID 1090 - Compound Summary, su pubchem.ncbi.nlm.nih.gov, National Center for Biotechnology Information. URL consultato il 9 gennaio 2019.
- ^ (EN) IUPAC Commission on Isotopic Abundances and Atomic Weights., Atomic weights of the elements 2017, su Queen Mary University of London.
- ^ Scheda del composto su ARPA
- ^ Scheda del composto su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ a b (EN) Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman, Inorganic chemistry, Academic Press, 2001, p. 583, ISBN 978-0-12-352651-9. URL consultato il 27 dicembre 2010. Ospitato su Google ricerca libri.
- ^ (EN) Francesco A. Devillanova, Handbook of chalcogen chemistry, RSCPublishing, 2007, p. 354, ISBN 978-0-85404-366-8. URL consultato il 27 dicembre 2010. Ospitato su Google ricerca libri.
- ^ J. E. Hoffmann & M. G. King: Selenium and Selenium Compounds, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2001 Versione web Accesso 27.12.2010
- ^ Bernd E. Langner: Selenium and Selenium Compounds Compounds, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2002 Versione web Accesso 27.12.2010
- ^ (EN) N.N. Greenwood & A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth Heinemann, 1992, p. 778, ISBN 0-7506-3365-4.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Selenito
Wikimedia Commons contiene immagini o altri file su Selenito

