Cloruro di esamminocobalto(III)
| Cloruro di esamminocobalto(III) | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Cloruro di esamminocobalto(III) | |
| Nomi alternativi | |
| Cobalto esammino cloruro | |
| Caratteristiche generali | |
| Formula bruta o molecolare | H18N6Cl3Co |
| Massa molecolare (u) | 267,48 |
| Aspetto | solido giallo arancio |
| Numero CAS | |
| Numero EINECS | 234-103-9 |
| PubChem | 159295 |
| SMILES | N.N.N.N.N.N.Cl[Co](Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,71 |
| Solubilità in acqua | 0,26 M (20 °C) |
| Temperatura di fusione | si decompone |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi R | 40-43 |
| Frasi S | 24‐37 [1] |
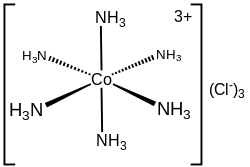
Il cloruro di esamminocobalto(III) è il composto chimico di formula [Co(NH3)6]Cl3. Questo composto di coordinazione è considerato un prototipo di "complesso di Werner", dal nome di Alfred Werner, pioniere della chimica di coordinazione. Il sale contiene il catione complesso [Co(NH3)6]3+ e tre anioni Cl–.
Storia[modifica | modifica wikitesto]
[Co(NH3)6]Cl3 fu descritto per la prima volta da Fremy nel 1852.[2]
Struttura e proprietà[modifica | modifica wikitesto]
Il [Co(NH3)6]3+ è un complesso ottaedrico a basso spin del Co(III), diamagnetico. In condizioni normali è un solido giallo arancio. Nello spettro di assorbimento sono presenti bande di trasferimento di carica legante→metallo a lunghezza d'onda inferiore a 250 nm e bande centrate sul metallo a circa 330 e 470 nm; quest'ultima è responsabile del colore del composto.[3]
Sintesi[modifica | modifica wikitesto]
La sintesi del [Co(NH3)6]Cl3 parte da CoCl2·6H2O, perché il corrispondente sale di Co(III) non è stabile. Dapprima CoCl2·6H2O è trattato con ammoniaca e cloruro d'ammonio. In seguito si procede all'ossidazione usando perossido di idrogeno o ossigeno in presenza di un catalizzatore di carbone.[4]
Gli anioni cloruro in [Co(NH3)6]Cl3 possono essere scambiati facilmente con altri anioni come nitrato, bromuro e ioduro ottenendo il corrispondente derivato [Co(NH3)6]X3. Questi sali sono anch'essi di colore giallo arancio e hanno solubilità differenti in acqua.
Alternativamente si possono usare procedure di sintesi differenti. Ad esempio l'acetato si può preparare per ossidazione all'aria in metanolo utilizzando acetato di cobalto(II), acetato d'ammonio e ammoniaca.[5] L'acetato è molto più solubile in acqua (1,9 M a 20 °C) rispetto al cloruro (0,26 M a 20 °C).
Reattività[modifica | modifica wikitesto]
[Co(NH3)6]3+ rappresenta un classico esempio di complesso inerte alla sostituzione dei leganti, tanto che può essere ricristallizzato immutato da acido cloridrico concentrato. In seguito a riscaldamento [Co(NH3)6]3+ può invece perdere i leganti ammoniaca. I leganti ammoniaca possono essere persi anche per irradiazione UV.
[Co(NH3)6]3+ è utilizzato in alcuni metodi di cristallizzazione delle proteine per poterne risolvere la struttura tramite cristallografia a raggi X.
Note[modifica | modifica wikitesto]
- ^ (EN) Hexaamminecobalt(III) chloride, 99% (CAS 10534-89-1), su Alfa Aesar. URL consultato il 4 giugno 2021 (archiviato dall'url originale il 1º settembre 2014).
- ^ M. E. Fremy, Recherches sur le cobalt, in Annales de chimie et de physique, vol. 35, 1852, pp. 257–311. URL consultato il 4 maggio 2011.
- ^ V. Balzani, V. Carassiti, Photochemistry of coordination compounds, Londra, Academic Press, 1970, ISBN 0-12-077250-7.
- ^ J. Bjerrum, J. P. McReynolds, Hexamminecobalt(III) salts, in Inorg. Synth., vol. 2, 1946, pp. 216–221, DOI:10.1002/9780470132333.ch69. URL consultato il 9 maggio 2011.
- ^ R. D. Lindholm, Complexes of cobalt containing ammonia or ethylen diamine: hexaamminecobalt(III) salts, in Inorg. Synth., vol. 18, 1978, pp. 67–69, DOI:10.1002/9780470132494.ch14. URL consultato il 9 maggio 2011.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Cloruro di esamminocobalto(III)
Wikimedia Commons contiene immagini o altri file su Cloruro di esamminocobalto(III)