Triosmio dodecacarbonile
| Triosmio dodecacarbonile | |
|---|---|
 | |
| Nome IUPAC | |
| triosmio dodecacarbonile | |
| Nomi alternativi | |
| dodecacarboniltriosmio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C12O12Os3 |
| Aspetto | solido |
| Numero CAS | |
| Numero EINECS | 239-789-3 |
| PubChem | 519165 |
| SMILES | [C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[Os].[Os].[Os] |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 224 °C (497 K)[1] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| Frasi H | 302 - 315 - 319 - 335 [2] |
| Consigli P | 261 - 305+351+338 [2] |
Il triosmio dodecacarbonile è il composto chimico cluster con formula Os3(CO)12. È uno dei carbonili binari stabili dell'osmio. In condizioni normali è un solido giallo, insolubile in acqua ma leggermente solubile in solventi organici. Disponibile in commercio, viene usato come precursore per la sintesi di altri composti organometallici di osmio.[1][3]
Struttura[modifica | modifica wikitesto]
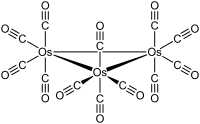
Os3(CO)12 cristallizza con struttura cristallina monoclina, gruppo spaziale P21/c, con costanti di reticolo a = 810 pm, b = 1479 pm, c = 1464 pm e β = 100°, quattro unità di formula per cella elementare. Nella struttura sono presenti unità molecolari con simmetria D3h, formate da un triangolo pressoché equilatero di atomi di osmio; la distanza media Os-Os è di 288 pm. Ogni atomo di osmio è legato a quattro leganti CO, due in posizione assiale e due in posizione equatoriale.[4] La struttura è analoga a quella di Ru3(CO)12, mentre in Fe3(CO)12 due CO sono legati a ponte e la simmetria diventa C2v.
Sintesi[modifica | modifica wikitesto]
Il cluster fu sintetizzato per la prima volta nel 1943 da Walter Hieber facendo reagire tetrossido di osmio con monossido di carbonio sotto pressione, attribuendogli però erroneamente la formula Os2(CO)9.[5] Nel 1961 Eugene R. Corey e Lawrence F. Dahl evidenziarono che la formula corretta era Os3(CO)12.[6] Con un accurato controllo delle condizioni la resa è pressoché quantitativa:[7]
Reattività[modifica | modifica wikitesto]
Os3(CO)12 è uno dei carbonili binari stabili dell'osmio; sono noti anche Os2(CO)9, Os4(CO)15, Os5(CO)16, Os6(CO)18, Os7(CO)21, Os8(CO)23 e Os12(CO)30.[1][8]
Os3(CO)12 è un cluster saturo, nel senso che ciascun atomo di osmio soddisfa la regola dei 18 elettroni, e quindi il composto è relativamente poco reattivo.[3] Per riscaldamento oltre 120 ºC o per attivazione fotochimica uno o più leganti CO possono essere sostituiti da basi di Lewis L formando specie tipo Os3(CO)11L, Os3(CO)10L2 e Os3(CO)9L3. Leganti L tipici sono fosfine, fosfiti, ossidi di fosfine (OPR3), ammine, acetonitrile (MeCN). L'acetonitrile in particolare è un legante molto labile e quindi i composti Os3(CO)11(MeCN) e Os3(CO)10(MeCN)2 trovano impiego come precursori per altri cluster di osmio.[9]
I leganti CO possono essere sostituiti anche da idrogeno, alcheni e alchini; questi nuovi leganti tendono a legarsi a ponte, come ad esempio in Os3(μ-H)2(CO)10 e Os3(μ-PhC≡CPh)2(CO)10.[3]
La pirolisi di Os3(CO)12 permette di ottenere cluster a nuclearità maggiore. In questo processo possono essere addizionati altri atomi come idrogeno e calcogeni. Due esempi sono Os4(CO)12H2 e Os4(CO)12(μ3-S).[3]
Note[modifica | modifica wikitesto]
Bibliografia[modifica | modifica wikitesto]
- (EN) E. R. Corey e L. F. Dahl, Trinuclear osmium and ruthenium carbonyls and their identities with previously reported Os2(CO)9 and Ru2(CO)9, in J. Am. Chem. Soc., vol. 83, n. 9, 1961, pp. 2203-2204, DOI:10.1021/ja01470a044.
- (EN) E. R. Corey e L. F. Dahl, The Molecular and Crystal Structure of Os3(CO)12, in Inorg. Chem., vol. 1, n. 3, 1962, pp. 521–526, DOI:10.1021/ic50003a016.
- (EN) S. R. Drake e P. A. Loveday, Dodecarbonyltriosmium, in Inorg. Synth., vol. 28, 1990, pp. 230–231, DOI:10.1002/9780470132593.ch57.
- (DE) W. Hieber e H. Stallman, Über Osmiumcarbonyle, in Z. Elektrochem., vol. 49, 1943, pp. 288-292.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) J. N. Nicholls e M. D. Vargas, Some Useful Derivatives of Dodecarbonyltriosmium, in Inorg. Synth., vol. 28, 1990, pp. 232–235, DOI:10.1002/9780470132593.ch58.
- (EN) P. R. Raithby e A. L. Johnson, Trinuclear Clusters of Ru/Os without Hydrocarbon Ligands, in D. M. P. Mingos e R. H. Crabtree (a cura di), Comprehensive Organometallic Chemistry III, 6: Compounds of Group 8, Elsevier, 2007, ISBN 978-0-08-045047-6.
- (EN) P. A. Shapley, Osmium: Organometallic Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia172, ISBN 9780470862100.
- Sigma-Aldrich, Scheda di dati di sicurezza del trirutenio dodecacarbonile, su sigmaaldrich.com, 2019. URL consultato il 16 marzo 2020.
- (EN) J. S.-Y. Wong, Z.-Y. Lin e W.-T. Wong, Synthesis and Structural Characterization of a Novel Dodecaosmium Carbonyl Cluster [Os12(CO)30] Derived from a New μ4-Oxo Hexaosmium Carbonyl Cluster [Os6(CO)16(μ4-O)(μ-OH)2(μ-CO)2], in Organometallics, vol. 22, n. 23, 2003, pp. 4798-4802, DOI:10.1021/om030271t.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su triosmio dodecacarbonile
Wikimedia Commons contiene immagini o altri file su triosmio dodecacarbonile
