Ossidazione degli alcoli
L'ossidazione degli alcoli è un insieme di reazioni di ossidazione in chimica organica che convertono gli alcoli in aldeidi, chetoni, acidi carbossilici ed esteri nei quali il carbonio presenta uno stato di ossidazione più elevato. La reazione di ossidazione di un alcol comporta la rimozione dal substrato alcolico di due atomi di idrogeno, uno dall'ossigeno ossidrilico, l'altro dal carbonio legato all'ossigeno, con formazione di un doppio legame C=O.[1]
La reazione si applica principalmente agli alcoli primari e secondari. Gli alcoli secondari formano chetoni, mentre gli alcoli primari formano aldeidi o acidi carbossilici.[2]
La reazione può avvenire utilizzando una varietà di ossidanti.

In linea di principio, un modo semplice per ossidare un alcool utilizza un atomo di ossigeno e produce acqua: in pratica, gli atomi di ossigeno singoli non sono disponibili, quindi l'equazione di cui sopra è solo concettuale. La maggior parte delle ossidazioni utilizza invece reagenti a base di ossidi, come solfossidi e ossidi di iodio.
Attraverso una varietà di meccanismi, la rimozione di un idruro equivalente converte un alcol primario o secondario rispettivamente in un'aldeide o in un chetone. L'ossidazione degli alcoli primari in acidi carbossilici avviene normalmente tramite la corrispondente aldeide, che viene trasformata tramite una aldeide idrata mediante reazione con acqua. Pertanto, l'ossidazione di un alcol primario a livello di aldeide senza ulteriore ossidazione ad acido carbossilico è possibile eseguendo la reazione in assenza di acqua, in modo che non si possa formare alcun idrato di aldeide.
Formazione di chetoni e aldeidi[modifica | modifica wikitesto]

Molti reagenti ossidano gli alcoli secondari in chetoni e gli alcoli primari in aldeidi. Gli alcoli allilici e benzilici rappresentano casi particolari. Le aldeidi sono suscettibili alla sovraossidazione con gli acidi carbossilici.
Reagenti del cromo(VI)[modifica | modifica wikitesto]

I reagenti al cromo(VI) sono comunemente usati per queste ossidazioni. Una famiglia di reagenti di Cr(VI) utilizza il complesso CrO3(piridina)2.[3]
- Reattivo di Sarett: una soluzione di CrO3(piridina) 2 in piridina. È stato reso popolare per l'ossidazione selettiva di alcoli primari e secondari in composti carbonilici.
- Reattivo di Collins: una soluzione dello stesso CrO3(piridina)2 ma in diclorometano. La variante di Ratcliffe del reattivo di Collins riguarda i dettagli della preparazione di questa soluzione, cioè l'aggiunta di triossido di cromo ad una soluzione di piridina in cloruro di metilene.[4]
Una seconda famiglia di reagenti al Cr(VI) sono i sali contenenti il catione piridinio (C5H5NH+).
- il dicromato di piridinio (PDC) è il sale di piridio del dicromato, [Cr2O7]2- .
- Il Piridinio clorocromato (PCC) è il sale di piridinio di [CrO3Cl]− .
Questi sali sono meno reattivi, più facili da maneggiare e più selettivi del reattivo di Collins nelle ossidazioni degli alcoli.
I reagenti di cui sopra rappresentano miglioramenti rispetto al vecchio reagente di Jones, una soluzione di triossido di cromo in acido solforico acquoso.
Dess–Martin e relative ossidazioni[modifica | modifica wikitesto]
Il periodinano Dess-Martin è un blando ossidante per la conversione degli alcoli in aldeidi o chetoni.[5] La reazione viene eseguita in condizioni standard, a temperatura ambiente, molto spesso in diclorometano. Il completamento della reazione richiede da mezz'ora a due ore.[6] Sono stati sviluppati molti ossidanti a base di iodosile, ad esempio IBX .
Ossidazione di Swern[modifica | modifica wikitesto]
L'ossidazione di Swern utilizza ossalil cloruro, dimetilsolfossido e una base organica, come la trietilammina .
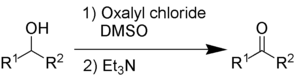
I sottoprodotti sono dimetilsolfuro (Me2S), monossido di carbonio (CO), biossido di carbonio (CO2) e, quando si utilizza la trietilammina come base, cloruro di trietilammonio (C6H15NHCl).
Ossidazione di Oppenauer[modifica | modifica wikitesto]
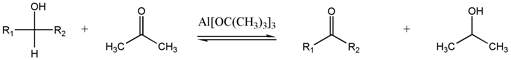
Questo metodo, usato raramente, interconverte alcoli e carbonili.
Ossidazione dei dioli[modifica | modifica wikitesto]

I composti che possiedono due gruppi ossidrili situati su carboni adiacenti, ovvero i dioli vicinali, subiscono una rottura ossidativa in corrispondenza di un legame carbonio-carbonio con alcuni ossidanti come il periodato di sodio (NaIO4) o tetraacetato di piombo (Pb(OAc)4), con conseguente generazione di due gruppi carbonilici. La reazione è anche nota come scissione del glicole .
Ossidazione di alcoli primari ad acidi carbossilici[modifica | modifica wikitesto]

Quando un alcol primario viene convertito in un acido carbossilico, l'atomo di carbonio terminale aumenta di quattro il suo stato di ossidazione . L'ossidazione diretta degli alcoli primari ad acidi carbossilici può essere effettuata utilizzando una varietà di reagenti.
Le aldeidi vengono facilmente ossidate utilizzando i reagenti Cr(VI) e Mn(VII) in acidi carbossilici.
Permanganato di potassio[modifica | modifica wikitesto]
Il permanganato di potassio (KMnO4) ossida gli alcoli primari in acidi carbossilici in modo molto efficiente. Questa reazione, descritta per la prima volta in dettaglio da Fournier,[7][8] viene tipicamente effettuata aggiungendo KMnO4 ad una soluzione o sospensione dell'alcol in una soluzione acquosa alcalina. Affinché la reazione proceda efficacemente è necessario che l'alcool sia almeno parzialmente disciolto nella soluzione acquosa. Ciò può essere facilitato dall'aggiunta di un cosolvente organico come diossano, piridina, acetone o t-BuOH . KMnO4 reagisce con molti gruppi funzionali, come alcoli secondari, 1,2-dioli, aldeidi, alcheni, ossime, solfuri e tioli e doppi legami carbonio-carbonio. Pertanto, la selettività è un problema.

Ossidazione di Jones[modifica | modifica wikitesto]
Il cosiddetto reagente di Jones, preparato dal triossido di cromo (CrO3) e dall'acido solforico acquoso, ossida gli alcoli in un acido carbossilico. Il protocollo prevede spesso notevoli quantità di esteri.[3] I problemi sono la tossicità e l'ostilità ambientale del reagente. Sono state descritte varianti catalitiche, che prevedono il trattamento con eccesso di acido periodico (H5IO6).[10]
Ossidazione in due fasi di alcoli ad acidi tramite aldeidi isolate[modifica | modifica wikitesto]
Poiché molte delle condizioni sopra menzionate per l'ossidazione degli alcoli primari in acidi sono severe e non compatibili con i comuni gruppi protettivi, i chimici organici utilizzano spesso una procedura in due fasi per l'ossidazione in acidi. L'alcol viene ossidato in un'aldeide utilizzando una delle tante procedure sopra descritte. Questa sequenza viene spesso utilizzata nella sintesi di prodotti naturali come nella sintesi della platencina.[11]
Note[modifica | modifica wikitesto]
- ^ Chemistry storylines, collana Salters advanced chemistry, 2nd ed., [repr.], Heinemann, 2005, ISBN 978-0-435-63119-2.
- ^ Burton, George et al. (2000). Salters Advanced Chemistry: Chemical (2nd ed.). Heinemann. ISBN 0-435-63120-9
- ^ a b Chromium-based Reagents, in Oxidation of Alcohols to Aldehydes and Ketones, Basic Reactions in Organic Synthesis, 2006, pp. 1–95, DOI:10.1007/0-387-25725-X_1, ISBN 0-387-23607-4.
- ^ J. C. Collins, W.W. Hess, Aldehydes from Primary Alcohols by Oxidation with Chromium Trioxide: Heptanal, in Organic Syntheses, vol. 52, 1972, pp. 5, DOI:10.15227/orgsyn.052.0005.
- ^ Dess, D. B.; Martin, J. C. J. Am. Chem. Soc. 1991, 113, 7277–87.
- ^ J. S Yadav, B. V. S Reddy e A. K Basak, Recyclable 2nd generation ionic liquids as green solvents for the oxidation of alcohols with hypervalent iodine reagents, in Tetrahedron, vol. 60, n. 9, 23 febbraio 2004, pp. 2131–2135, DOI:10.1016/j.tet.2003.12.056. URL consultato il 26 febbraio 2024.
- ^ Fournier, H.M., Transformation des alcools primaires saturès en acides monobasiques correspondants, in C. R. Acad. Sci., 1907, pp. 331.
- ^ Fournier, H.M., Sur la préparation des acides gras et de leurs anhydres, in Bull. Soc. Chim. Fr., 20 luglio 1909, pp. 920.
- ^ vol. 30, 1989, DOI:10.1016/S0040-4039(00)99393-6, https://oadoi.org/10.1016/S0040-4039(00)99393-6.
- ^ Song, Z.J., Zhao, M., Desmond, R., Devine, P., Tschaen, D.M., Tillyer, R., Frey, L., Heid, R., Xu, F., Foster, B., Li, J., Reamer, R., Volante, R., Grabowski, E.J.J., Dolling, U.H. e Reider, P.J., Practical Asymmetric Synthesis of an Endothelin Receptor Antagonist, in J. Org. Chem., vol. 64, n. 26, 1999, pp. 9658, DOI:10.1021/jo991292t.
- ^ Nicolaou K.C., Scott Tria G. e Edmonds D. J., Total Synthesis of Platencin, in Angew. Chem., vol. 120, n. 9, 2008, pp. 1804, DOI:10.1002/ange.200800066.