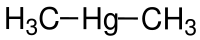Dimetilmercurio
| Dimetilmercurio | |
|---|---|
 | |
| Nome IUPAC | |
| Dimetilmercurio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C2H6Hg |
| Massa molecolare (u) | 230,659 |
| Aspetto | Liquido incolore |
| Numero CAS | |
| Numero EINECS | 209-805-3 |
| PubChem | 11645 |
| SMILES | C[Hg]C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,96 |
| Solubilità in acqua | Insolubile |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 300 - 310 - 330 - 373 - 410 |
| Consigli P | 260 - 264 - 273 - 280 - 284 - 301+310 [1] |
Il dimetilmercurio è un liquido incolore infiammabile, conosciuto come una delle più potenti neurotossine. È descritto come avente un odore lievemente dolce, anche se l'inalazione di vapore sufficiente per notare questo comporterebbe una significativa esposizione alla sostanza chimica.
Sintesi, struttura e reazioni[modifica | modifica wikitesto]
Il dimetilmercurio è stato uno dei primi composti organometallici a essere sintetizzati. Viene preparato trattando un amalgama di sodio e mercurio con alogenuri metilici:
- Hg + 2 Na + 2CH3I → Hg(CH3)2 + 2 NaI
Può essere ottenuto anche attraverso un'alchilazione del cloruro mercurico con il metillitio:
- HgCl2 + 2 LiCH3 → Hg(CH3)2 + 2 LiCl
La molecola assume una struttura lineare con una lunghezza dei legami Hg-C pari a 2,083 Å.
La caratteristica più evidente del composto è la sua non reattività nei confronti dell'acqua, a differenza dei corrispondenti composti organocadmio e organozinco che si idrolizzano rapidamente. Questo differente comportamento è da attribuire alla bassa affinità del mercurio(II) nei confronti dei ligandi con l'ossigeno.
Il dimetilmercurio reagisce con il cloruro mercurico per dare un composto cloro-metilico (solido cristallino):
- Hg(CH3)2 + HgCl2 → ClHgCH3
Usi[modifica | modifica wikitesto]
A causa della sua elevata tossicità, il dimetilmercurio oggi è raramente utilizzato. Come molti altri composti organometallici metilici, è un agente metilante che può donare i suoi gruppi metilici a una molecola organica. Lo sviluppo di nucleofili meno tossici come il dimetilzinco e il trimetilalluminio e la successiva introduzione dei reattivi di Grignard (alogenuri organometallici), ha reso obsoleto l'utilizzo di questo composto.
In passato sono state studiate delle reazioni in cui il catione metilmercurio veniva legato a una specifica molecola, formando potenti battericidi. Il bioaccumulo e la tossicità del metilmercurio hanno portato alla sospensione del suo utilizzo in questo ambito ed è stato sostituito dal catione etilmercurico che svolge le stesse funzioni senza il pericolo di bioaccumulo in quanto metabolizzato a livello epatico.
In tossicologia, è stato utilizzato come una tossina di riferimento. È stato utilizzato anche per la calibrazione degli spettrometri NMR nella ricerca del mercurio[2], sebbene siano preferiti dei sali del mercurio meno tossici.
Sicurezza[modifica | modifica wikitesto]
L'elevata pressione di vapore del liquido comporta che qualsiasi versamento si tradurrà in livelli pericolosi di esposizione ai vapori per chi si trova nelle vicinanze.
La molecola ha una struttura lineare ed è in grado di attraversare la barriera emato-encefalica facilmente, probabilmente a causa della formazione di un complesso con la cisteina. Viene eliminato dall'organismo molto lentamente, pertanto ha la tendenza al bioaccumulo. I sintomi di avvelenamento possono comparire anche dopo molti mesi, spesso troppo tardi per un trattamento chelante efficace, quando il mercurio ha già causato importanti danni neurologici.
Il dimetilmercurio passa attraverso lattice, PVC, butile e neoprene in pochi secondi ed è assorbito attraverso la pelle. Pertanto la maggior parte dei guanti di laboratorio non forniscono una protezione adeguata da esso e l'unica precauzione di sicurezza è quello di indossare guanti molto resistenti e laminati. Una maschera protettiva per il viso e il lavoro sotto una cappa d'aspirazione sono raccomandati[3].
La tossicità del dimetilmercurio venne tristemente evidenziata quando una famosa chimica esperta in metalli pesanti, Karen Wetterhahn, morì nel 1997 dieci mesi dopo che qualche goccia di questa sostanza cadde accidentalmente sul guanto in lattice che indossava.
Note[modifica | modifica wikitesto]
- ^ Sigma Aldrich; rev. del 12.12.2012
- ^ Mercury NMR, su chem.ch.huji.ac.il, The Hebrew University of Jerusalem Institute of Chemistry. URL consultato l'11 luglio 2015.
- ^ Dimethylmercury Hazard Information Bulletin, su Occupational Safety and Health Administration. URL consultato il 10 luglio 1991.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Dimetilmercurio
Wikimedia Commons contiene immagini o altri file su Dimetilmercurio
Collegamenti esterni[modifica | modifica wikitesto]
- ATSDR - ToxFAQs: Mercury, su atsdr.cdc.gov. URL consultato il 19 settembre 2009 (archiviato dall'url originale il 6 ottobre 1999).
- ATSDR - Public Health Statement: Mercury, su atsdr.cdc.gov. URL consultato il 19 settembre 2009 (archiviato dall'url originale il 2 agosto 2002).
- ATSDR - ALERT! Patterns of Metallic Mercury Exposure, 6/26/97, su atsdr.cdc.gov. URL consultato il 19 settembre 2009 (archiviato dall'url originale il 15 gennaio 2000).
- ATSDR - MMG: Mercury, su atsdr.cdc.gov. URL consultato il 19 settembre 2009 (archiviato dall'url originale il 2 agosto 2003).
- ATSDR - Toxicological Profile: Mercury, su atsdr.cdc.gov. URL consultato il 19 settembre 2009 (archiviato dall'url originale il 18 luglio 2001).
- National Pollutant Inventory - Mercury and compounds Fact Sheet, su npi.gov.au. URL consultato il 19 settembre 2009 (archiviato dall'url originale il 25 aprile 2006).