Studio controllato randomizzato: differenze tra le versioni
→Note: voci correlate |
→Per ipotesi (superiorità vs non inferiorità vs equivalenza): ampliamento con traduzione dalla voce Randomized controlled trial su en.wikipedia.org |
||
| Riga 41: | Riga 41: | ||
===Per ipotesi (superiorità vs non inferiorità vs equivalenza)=== |
===Per ipotesi (superiorità vs non inferiorità vs equivalenza)=== |
||
Un'altra classificazione degli RCT li classifica come "prove di superiorità", "prove di non inferiorità" e "prove di equivalenza", che differiscono nella metodologia e nella segnalazione<ref name="Piaggio-2006">{{Cite journal | author = Piaggio G, Elbourne DR, [[Doug Altman|Altman DG]], [[Stuart Pocock|Pocock SJ]], Evans SJ; CONSORT Group | title = Reporting of noninferiority and equivalence randomized trials: an extension of the CONSORT statement | journal = JAMA | volume = 295 | issue = 10 | pages = 1152–60 | year = 2006 | doi = 10.1001/jama.295.10.1152 | url = http://jama.ama-assn.org/cgi/content/full/295/10/1152 | pmid = 16522836 }}</ref>. La maggior parte degli RCT sono studi di superiorità, in cui si ipotizza che un intervento sia superiore a un altro in modo [[Significatività|statisticamente significativo]]<ref name="Piaggio-2006"/>. Alcuni RCT sono studi di non inferiorità "per determinare se un nuovo trattamento non è peggiore di un trattamento di riferimento."<ref name="Piaggio-2006"/> Altri RCT sono studi di equivalenza in cui l'ipotesi è che due interventi siano indistinguibili l'uno dall'altro<ref name="Piaggio-2006"/>. |
Un'altra classificazione degli RCT li classifica come "prove di superiorità", "prove di non inferiorità" e "prove di equivalenza", che differiscono nella metodologia e nella segnalazione<ref name="Piaggio-2006">{{Cite journal | author = Piaggio G, Elbourne DR, [[Doug Altman|Altman DG]], [[Stuart Pocock|Pocock SJ]], Evans SJ; CONSORT Group | title = Reporting of noninferiority and equivalence randomized trials: an extension of the CONSORT statement | journal = JAMA | volume = 295 | issue = 10 | pages = 1152–60 | year = 2006 | doi = 10.1001/jama.295.10.1152 | url = http://jama.ama-assn.org/cgi/content/full/295/10/1152 | pmid = 16522836 }}</ref>. La maggior parte degli RCT sono studi di superiorità, in cui si ipotizza che un intervento sia superiore a un altro in modo [[Significatività|statisticamente significativo]]<ref name="Piaggio-2006"/>. Alcuni RCT sono studi di non inferiorità "per determinare se un nuovo trattamento non è peggiore di un trattamento di riferimento."<ref name="Piaggio-2006"/> Altri RCT sono studi di equivalenza in cui l'ipotesi è che due interventi siano indistinguibili l'uno dall'altro<ref name="Piaggio-2006"/>. |
||
==Randomizzazione== |
|||
La randomizzazione (cioè l'assegnazione casuale dei partecipanti ai gruppi) è il più importante aspetto e il tratto distintivo degli RCT. I vantaggi della corretta randomizzazione negli RCT includono<ref name="SchulzGrimes2002">{{Cite journal |vauthors=Schulz KF, Grimes DA | title = Generation of allocation sequences in randomised trials: chance, not choice | journal = Lancet | volume = 359 | issue = 9305 | pages = 515–9 | year = 2002 | doi = 10.1016/S0140-6736(02)07683-3 | url = http://www.who.int/entity/rhl/LANCET_515-519.pdf | pmid = 11853818 }}</ref>: |
|||
* "Elimina pregiudizi nell'assegnazione del trattamento", in particolare [[Effetto di selezione|bias di selezione]] e [[Confondente|variabili confondenti]]. |
|||
* "Facilita il mascheramento dell'identità dei trattamenti da parte di investigatori, partecipanti e valutatori". |
|||
* "Permette l'uso della [[teoria della probabilità]] per esprimere la probabilità che qualsiasi differenza nel risultato tra i gruppi di trattamento indichi semplicemente il caso." |
|||
Ci sono due processi coinvolti nel randomizzare i pazienti in diversi interventi. La prima è scegliere una ''procedura di randomizzazione'' per generare una sequenza imprevedibile di assegnazioni; questo può essere un semplice assegnamento casuale di pazienti a uno dei gruppi a parità di probabilità, può essere "limitato" o può essere "adattivo". Una seconda e più pratica procedura è l'''occultamento dell'assegnazione'', che si riferisce alle severe precauzioni adottate per garantire che l'assegnazione di gruppo dei pazienti non sia rivelata prima di assegnarli definitivamente ai rispettivi gruppi. Metodi "sistematici" non casuali di assegnazione di gruppo, come l'alternanza di soggetti tra un gruppo e l'altro, possono causare "possibilità di contaminazione illimitate" e possono causare una violazione dell'occultamento delle assegnazioni<ref name="Schulz-2002"/>. |
|||
Tuttavia, l'evidenza empirica che un'adeguata randomizzazione modifica i risultati rispetto alla randomizzazione inadeguata è stata difficile da rilevare<ref name="Howick-2014">{{Cite journal |vauthors=Howick J, Mebius A | title = In search of justification for the unpredictability paradox | journal = Trials | volume = 15 | pages = 480 | year = 2014 | doi = 10.1186/1745-6215-15-480 | url = http://www.trialsjournal.com/content/15/1/480 | pmid = 25490908 | pmc=4295227}}</ref>. |
|||
==Note== |
==Note== |
||
Versione delle 20:08, 12 dic 2018
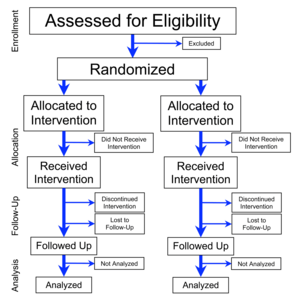
Uno studio controllato randomizzato (RCT, dall'inglese randomized controlled trial) è un tipo di esperimento scientifico (spesso clinico) che mira a ridurre i bias durante la sperimentazione di un nuovo trattamento. Le persone che partecipano allo studio sono assegnate casualmente al gruppo che riceve il trattamento in esame o a un gruppo che riceve un trattamento standard (o un trattamento placebo) come controllo. La randomizzazione riduce al minimo l'effetto di selezione e i diversi gruppi di confronto consentono ai ricercatori di determinare gli eventuali effetti del trattamento rispetto al gruppo senza trattamento (controllo), mentre altre variabili sono mantenute costanti. L'RCT è spesso considerato il gold standard per una sperimentazione clinica. Gli RCT sono spesso usati per testare l'efficacia di vari tipi di intervento medico e possono fornire informazioni sugli effetti avversi, come le reazioni ai farmaci. L'assegnazione casuale dell'intervento viene eseguita dopo che i soggetti sono stati valutati per l'ammissibilità e reclutati, ma prima che inizi l'intervento da studiare.
L'allocazione casuale dei partecipanti è complessa, ma concettualmente il processo è come lanciare una moneta. Dopo la randomizzazione, i due (o più) gruppi di soggetti sono seguiti esattamente nello stesso modo e le uniche differenze tra loro sono le cure che ricevono. Ad esempio, in termini di procedure, test, visite ambulatoriali e chiamate di follow-up, dovrebbero essere quelle intrinseche ai trattamenti da confrontare. Il vantaggio più importante della corretta randomizzazione è che minimizza i bias di allocazione, bilanciando sia fattori prognostici noti che sconosciuti, nell'assegnazione dei trattamenti[2].
Terminologia
I termini "RCT" e "studio randomizzato" sono talvolta usati come sinonimi, ma la pratica metodologicamente corretta è di riservare il nome "RCT" solo per studi che contengono gruppi di controllo, in cui i gruppi che ricevono il trattamento sperimentale sono confrontati con gruppi di controllo che non ricevono alcun trattamento ( uno studio placebo-controllato) o un trattamento precedentemente testato (uno studio a controllo positivo). Il termine "studi randomizzati" omette la menzione dei controlli e può descrivere studi che confrontano più gruppi di trattamento l'uno con l'altro (in assenza di un gruppo di controllo)[3]. Allo stesso modo, sebbene il nome "RCT" sia talvolta esteso come "studio clinico randomizzato" o "studio comparativo randomizzato", la pratica metodologicamente corretta, per evitare l'ambiguità nella letteratura scientifica, è di mantenere il "controllo" nella definizione di "RCT" e quindi riservare quel nome solo per prove che contengono controlli. Non tutti gli studi clinici randomizzati sono trial controllati randomizzati (e alcuni di essi potrebbero non esserlo mai, nei casi in cui i controlli sarebbero poco pratici o non etici da istituire). Il termine "studi clinici controllati randomizzati" è un'espansione metodologicamente corretta per "RCT", in RCT che riguardano la ricerca clinica;[4][5][6] tuttavia, gli RCT sono impiegati anche in altre aree di ricerca, incluse molte delle scienze sociali.
Storia
Il primo studio clinico riportato in letteratura fu condotto da James Lind nel 1747 per identificare il trattamento per lo scorbuto[7]. Esperimenti randomizzati sono apparsi in psicologia, dove sono stati introdotti da Charles Sanders Peirce[8], e in ambito educativo[9][10][11]. Più tardi, esperimenti randomizzati sono apparsi in agricoltura, per merito di Jerzy Neyman[12] e Ronald Fisher. La ricerca sperimentale di Fisher e i suoi scritti hanno reso popolari gli esperimenti randomizzati[13].
Il primo RCT pubblicato in medicina apparve nel documento del 1948 intitolato "Streptomycin treatment of tuberculosis polmonary", che descriveva un'indagine del Medical Research Council[14][15][16]. Uno degli autori di quel documento era Austin Bradford Hill, a cui è stato attribuito il merito di aver concepito il moderno RCT[17].
Verso la fine del 20° secolo, gli RCT furono riconosciuti come il metodo standard per le "terapie razionali" in medicina[18]. A partire dal 2004, più di 150.000 RCT erano nella Biblioteca Cochrane. [17] Per migliorare la segnalazione degli RCT nella letteratura medica, un gruppo internazionale di scienziati e redattori ha pubblicato i "Consolidated Standards of Reporting Trials" (CONSORT) nel 1996, 2001 e 2010, e questi sono stati ampiamente accettati[1][2].
Considerazioni etiche
Sebbene il principio dell'equilibrio clinico ("genuina incertezza all'interno della comunità medica esperta ... sul trattamento preferito") comune alle sperimentazioni cliniche[19] sia stato applicato agli RCT, l'etica degli RCT merita considerazioni speciali. Per prima cosa, è stato sostenuto che l'equilibrio stesso non è sufficiente per giustificare gli RCT[20]. In secondo luogo, l'"equilibrio collettivo" può entrare in conflitto con una mancanza di equilibrio personale (ad esempio, una convinzione personale che un intervento sia efficace)[21]. Infine, il disegno di Zelen, che è stato utilizzato per alcuni studi randomizzati, randomizza i soggetti prima che forniscano consenso informato, che può essere etico per studi randomizzati di screening e terapie selezionate, ma è probabilmente immorale "per la maggior parte degli studi terapeutici"[22][23].
Sebbene i soggetti forniscano quasi sempre il consenso informato per la loro partecipazione a un RCT, studi dal 1982 hanno documentato che i soggetti RCT possono ritenere di essere certi di ricevere il trattamento migliore per loro personalmente; cioè, non capiscono la differenza tra ricerca e cura[24][25]. Sono necessarie ulteriori ricerche per determinare la prevalenza e i modi per affrontare questo "malinteso terapeutico"[25].
Le variazioni del metodo RCT possono anche creare effetti culturali che non sono stati ben compresi[26]. Ad esempio, i pazienti con malattia terminale possono unirsi alle prove nella speranza di essere curati, anche quando è improbabile che i trattamenti abbiano successo.
Obbligo di registrazione
Nel 2004, l'International Committee of Medical Journal Editors (ICMJE) ha annunciato che tutti gli studi che iniziavano il reclutamento dopo il 1 luglio 2005 avrebbero dovuto essere registrati prima della presa in considerazione per la pubblicazione in uno dei 12 periodici membri del comitato[27]. Tuttavia, la registrazione degli studi può ancora verificarsi in ritardo o non verificarsi[28][29]. Le riviste mediche sono state lente nell'adottare le politiche che richiedono la registrazione obbligatoria degli studi clinici come prerequisito per la pubblicazione[30].
Classificazione
Per disegno sperimentale
Un modo per classificare gli RCT è rispetto al disegno sperimentale impiegato. Dal più al meno comune nella letteratura sanitaria, le principali categorie di studi RCT sono[31]:
- Gruppi paralleli: ciascun partecipante viene assegnato in modo casuale a un gruppo e tutti i partecipanti al gruppo ricevono (o non ricevono) un intervento.
- Studi incrociati (crossover): nel tempo, ogni partecipante riceve (o non riceve) un intervento in una sequenza casuale[32][33].
- Cluster: i gruppi preesistenti di partecipanti (ad es. Villaggi, scuole) vengono selezionati casualmente per ricevere (o non ricevere) un intervento.
- Studi fattoriali - ogni partecipante viene assegnato in modo casuale a un gruppo che riceve una particolare combinazione di interventi o non interventi (ad esempio, il gruppo 1 riceve vitamina X e vitamina Y, il gruppo 2 riceve vitamina X e placebo Y, il gruppo 3 riceve placebo X e vitamina Y e il gruppo 4 riceve placebo X e placebo Y).
Un'analisi dei 616 RCT indicizzati su PubMed nel dicembre 2006 ha rilevato che il 78% era costituito da studi a gruppi paralleli, il 16% da studi incrociati, il 2% da split-body, il 2% da cluster e il 2% da disegni fattoriali[31].
Per risultato di interesse
Gli RCT possono essere classificati come "esplicativi" o "pragmatici"[34]. Gli RCT esplicativi testano l'efficacia in un contesto di ricerca con partecipanti altamente selezionati e in condizioni altamente controllate[34]. Al contrario, gli RCT pragmatici (pRCT) testano l'efficacia nella pratica quotidiana con partecipanti relativamente non selezionati e in condizioni flessibili; in questo modo, gli RCT pragmatici possono "informare le decisioni sulla pratica"[34].
Per ipotesi (superiorità vs non inferiorità vs equivalenza)
Un'altra classificazione degli RCT li classifica come "prove di superiorità", "prove di non inferiorità" e "prove di equivalenza", che differiscono nella metodologia e nella segnalazione[35]. La maggior parte degli RCT sono studi di superiorità, in cui si ipotizza che un intervento sia superiore a un altro in modo statisticamente significativo[35]. Alcuni RCT sono studi di non inferiorità "per determinare se un nuovo trattamento non è peggiore di un trattamento di riferimento."[35] Altri RCT sono studi di equivalenza in cui l'ipotesi è che due interventi siano indistinguibili l'uno dall'altro[35].
Randomizzazione
La randomizzazione (cioè l'assegnazione casuale dei partecipanti ai gruppi) è il più importante aspetto e il tratto distintivo degli RCT. I vantaggi della corretta randomizzazione negli RCT includono[36]:
- "Elimina pregiudizi nell'assegnazione del trattamento", in particolare bias di selezione e variabili confondenti.
- "Facilita il mascheramento dell'identità dei trattamenti da parte di investigatori, partecipanti e valutatori".
- "Permette l'uso della teoria della probabilità per esprimere la probabilità che qualsiasi differenza nel risultato tra i gruppi di trattamento indichi semplicemente il caso."
Ci sono due processi coinvolti nel randomizzare i pazienti in diversi interventi. La prima è scegliere una procedura di randomizzazione per generare una sequenza imprevedibile di assegnazioni; questo può essere un semplice assegnamento casuale di pazienti a uno dei gruppi a parità di probabilità, può essere "limitato" o può essere "adattivo". Una seconda e più pratica procedura è l'occultamento dell'assegnazione, che si riferisce alle severe precauzioni adottate per garantire che l'assegnazione di gruppo dei pazienti non sia rivelata prima di assegnarli definitivamente ai rispettivi gruppi. Metodi "sistematici" non casuali di assegnazione di gruppo, come l'alternanza di soggetti tra un gruppo e l'altro, possono causare "possibilità di contaminazione illimitate" e possono causare una violazione dell'occultamento delle assegnazioni[37].
Tuttavia, l'evidenza empirica che un'adeguata randomizzazione modifica i risultati rispetto alla randomizzazione inadeguata è stata difficile da rilevare[38].
Note
- ^ a b Schulz KF, Altman DG, ((Moher D; for the CONSORT Group)), CONSORT 2010 Statement: updated guidelines for reporting parallel group randomised trials, in Br Med J, vol. 340, 2010, pp. c332, DOI:10.1136/bmj.c332.
- ^ a b Moher D, Hopewell S, Schulz KF, Montori V, Gøtzsche PC, Devereaux PJ, Elbourne D, Egger M, Altman DG, CONSORT 2010 explanation and elaboration: updated guidelines for reporting parallel group randomised trials, in Br Med J, vol. 340, 2010, pp. c869, DOI:10.1136/bmj.c869.
- ^ Ranjith G, Interferon-α-induced depression: when a randomized trial is not a randomized controlled trial, in Psychother Psychosom, vol. 74, n. 6, 2005, DOI:10.1159/000087787.
- ^ Peto R, Pike MC, Armitage P, Breslow NE, Cox DR, Howard SV, Mantel N, McPherson K, Peto J, Smith PG, Design and analysis of randomized clinical trials requiring prolonged observation of each patient. I. Introduction and design, in Br J Cancer, vol. 34, n. 6, 1976, pp. 585–612, DOI:10.1038/bjc.1976.220.
- ^ Peto R, Pike MC, Armitage P, Breslow NE, Cox DR, Howard SV, Mantel N, McPherson K, Peto J, Smith PG, Design and analysis of randomized clinical trials requiring prolonged observation of each patient. II. Analysis and examples, in Br J Cancer, vol. 35, n. 1, 1977, pp. 1–39, DOI:10.1038/bjc.1977.1.
- ^ Wollert KC, Meyer GP, Lotz J, Ringes-Lichtenberg S, Lippolt P, Breidenbach C, Fichtner S, Korte T, Hornig B, Messinger D, Arseniev L, Hertenstein B, Ganser A, Drexler H, Intracoronary autologous bone-marrow cell transfer after myocardial infarction: the BOOST randomised controlled clinical trial, in Lancet, vol. 364, n. 9429, 2004, pp. 141–8, DOI:10.1016/S0140-6736(04)16626-9.
- ^ Dunn PM, James Lind (1716-94) of Edinburgh and the treatment of scurvy (PDF), in Arch. Dis. Child. Fetal Neonatal Ed., vol. 76, January 1997, pp. F64–5, DOI:10.1136/fn.76.1.f64.
- ^ Charles Sanders Peirce and Joseph Jastrow, On Small Differences in Sensation, in Memoirs of the National Academy of Sciences, vol. 3, 1885, pp. 73–83. http://psychclassics.yorku.ca/Peirce/small-diffs.htm
- ^ Ian Hacking, Telepathy: Origins of Randomization in Experimental Design, in Isis, vol. 79, n. 3, September 1988, pp. 427–451, DOI:10.1086/354775.
- ^ Stephen M. Stigler, A Historical View of Statistical Concepts in Psychology and Educational Research, in American Journal of Education, vol. 101, n. 1, November 1992, pp. 60–70, DOI:10.1086/444032.
- ^ Trudy Dehue, Deception, Efficiency, and Random Groups: Psychology and the Gradual Origination of the Random Group Design, in Isis, vol. 88, n. 4, December 1997, pp. 653–673, DOI:10.1086/383850.
- ^ Neyman, Jerzy. 1923 [1990]. "On the Application of Probability Theory to AgriculturalExperiments. Essay on Principles. Section 9." Statistical Science 5 (4): 465–472. Trans. Dorota M. Dabrowska and Terence P. Speed.
- ^ Denis Conniffe, R. A. Fisher and the development of statistics—a view in his centenary year, Statistical and Social Inquiry Society of Ireland, p. 55–108.
H. B. Mann, Analysis and design of experiments: Analysis of variance and analysis of variance designs, New York, N. Y., Dover Publications, Inc, 1949, x+195.
- ^ Streptomycin in Tuberculosis Trials Committee, Streptomycin treatment of pulmonary tuberculosis. A Medical Research Council investigation, in Br Med J, vol. 2, n. 4582, 1948, pp. 769–82, DOI:10.1136/bmj.2.4582.769.
- ^ Brown D, Landmark study made research resistant to bias, 2 novembre 1998.
- ^ Shikata S, Nakayama T, Noguchi Y, Taji Y, Yamagishi H, Comparison of effects in randomized controlled trials with observational studies in digestive surgery, in Ann Surg, vol. 244, n. 5, 2006, pp. 668–76, DOI:10.1097/01.sla.0000225356.04304.bc.
- ^ a b Stolberg HO, Norman G, Trop I, Randomized controlled trials, in Am J Roentgenol, vol. 183, n. 6, 2004, pp. 1539–44, DOI:10.2214/ajr.183.6.01831539.
- ^ Meldrum ML, A brief history of the randomized controlled trial. From oranges and lemons to the gold standard, in Hematol Oncol Clin North Am, vol. 14, n. 4, 2000, pp. 745–60, vii, DOI:10.1016/S0889-8588(05)70309-9.
- ^ Freedman B, Equipoise and the ethics of clinical research, in N Engl J Med, vol. 317, n. 3, 1987, pp. 141–5, DOI:10.1056/NEJM198707163170304.
- ^ Gifford F, Community-equipoise and the ethics of randomized clinical trials, in Bioethics, vol. 9, n. 2, 1995, pp. 127–48, DOI:10.1111/j.1467-8519.1995.tb00306.x.
- ^ Edwards SJ, Lilford RJ, Hewison J, The ethics of randomised controlled trials from the perspectives of patients, the public, and healthcare professionals, in Br Med J, vol. 317, n. 7167, 1998, pp. 1209–12, DOI:10.1136/bmj.317.7167.1209.
- ^ Zelen M, A new design for randomized clinical trials, in N Engl J Med, vol. 300, n. 22, 1979, pp. 1242–5, DOI:10.1056/NEJM197905313002203.
- ^ Torgerson DJ, Roland M, What is Zelen's design?, in Br Med J, vol. 316, n. 7131, 1998, DOI:10.1136/bmj.316.7131.606.
- ^ Appelbaum PS, Roth LH, Lidz C, The therapeutic misconception: informed consent in psychiatric research, in Int J Law Psychiatry, vol. 5, 3–4, 1982, pp. 319–29, DOI:10.1016/0160-2527(82)90026-7.
- ^ a b Henderson GE, Churchill LR, Davis AM, Easter MM, Grady C, Joffe S, Kass N, King NM, Lidz CW, Miller FG, Nelson DK, Peppercorn J, Rothschild BB, Sankar P, Wilfond BS, Zimmer CR, Clinical trials and medical care: defining the therapeutic misconception, in PLoS Med, vol. 4, n. 11, 2007, pp. e324, DOI:10.1371/journal.pmed.0040324.
- ^ Jain SL, The mortality effect: counting the dead in the cancer trial, in Public Culture, vol. 21, n. 1, 2010, pp. 89–117, DOI:10.1215/08992363-2009-017.
- ^ De Angelis C, Drazen JM, Frizelle FA, etal, Clinical trial registration: a statement from the International Committee of Medical Journal Editors, in The New England Journal of Medicine, vol. 351, n. 12, September 2004, pp. 1250–1, DOI:10.1056/NEJMe048225.
- ^ Law MR, Kawasumi Y, Morgan SG, Despite law, fewer than one in eight completed studies of drugs and biologics are reported on time on ClinicalTrials.gov., in Health Aff (Millwood), vol. 30, n. 12, 2011, pp. 2338–45, DOI:10.1377/hlthaff.2011.0172.
- ^ Mathieu S, Boutron I, Moher D, Altman DG, Ravaud P, Comparison of registered and published primary outcomes in randomized controlled trials., in JAMA, vol. 302, n. 9, 2009, pp. 977–84, DOI:10.1001/jama.2009.1242.
- ^ Editorial policies of MEDLINE indexed Indian journals on clinical trial registration., in Indian Pediatr., vol. 50, n. 3, Mar 2013, pp. 339–40, DOI:10.1007/s13312-013-0092-2.
- ^ a b Hopewell S, Dutton S, Yu LM, Chan AW, Altman DG, The quality of reports of randomised trials in 2000 and 2006: comparative study of articles indexed in PubMed, in BMJ, vol. 340, 2010, pp. c723, DOI:10.1136/bmj.c723.
- ^ Byron Jones, Design and Analysis of Cross-Over Trials, Second, London: Chapman and Hall, 2003.
- ^ Edward F. Vonesh, Crossover Experiments, in Linear and Nonlinear Models for the Analysis of Repeated Measurements, London: Chapman and Hall, 1997, pp. 111–202.
- ^ a b c Zwarenstein M, Treweek S, Gagnier JJ, Altman DG, Tunis S, Haynes B, Oxman AD, Moher D; CONSORT group; Pragmatic Trials in Healthcare (Practihc) group, Improving the reporting of pragmatic trials: an extension of the CONSORT statement, in BMJ, vol. 337, 2008, pp. a2390, DOI:10.1136/bmj.a2390.
- ^ a b c d Piaggio G, Elbourne DR, Altman DG, Pocock SJ, Evans SJ; CONSORT Group, Reporting of noninferiority and equivalence randomized trials: an extension of the CONSORT statement, in JAMA, vol. 295, n. 10, 2006, pp. 1152–60, DOI:10.1001/jama.295.10.1152.
- ^ Schulz KF, Grimes DA, Generation of allocation sequences in randomised trials: chance, not choice (PDF), in Lancet, vol. 359, n. 9305, 2002, pp. 515–9, DOI:10.1016/S0140-6736(02)07683-3.
- ^ Errore nelle note: Errore nell'uso del marcatore
<ref>: non è stato indicato alcun testo per il marcatoreSchulz-2002 - ^ Howick J, Mebius A, In search of justification for the unpredictability paradox, in Trials, vol. 15, 2014, p. 480, DOI:10.1186/1745-6215-15-480.