Valnoctamide
| Valnoctamide | |
|---|---|
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C8H17NO |
| Aspetto | Bianco cristallino |
| Numero CAS | |
| Numero EINECS | 224-033-7 |
| Codice ATC | N05 |
| PubChem | 20140 |
| DrugBank | DB13099 |
| SMILES | CCC(C)C (CC)c (:[nH2]):[o] |
| Dati farmacologici | |
| Modalità di somministrazione | Orale, endovenosa |
| Dati farmacocinetici | |
| Biodisponibilità | 94% |
| Metabolismo | epatico |
| Emivita | 10 h |
| Indicazioni di sicurezza | |
Il valnoctamide è un farmaco utilizzato in Francia come sedativo dal 1964[1]. È un isomero conformazionale del valpromide, un profarmaco dell'acido valproico; a differenza di questo, il valnoctamide non viene, in vivo, trasformato nel suo acido omologo, l'acido valnoctico[2].
Indicazioni[modifica | modifica wikitesto]
Oltre alle proprietà sedative, il valnoctamide è stato studiato per il trattamento dell'epilessia sin dal 1969[3][4]. È stato studiato anche per il trattamento del dolore neuropatico, dimostrando buoni risultati: esso ha degli effetti minimi sulla coordinazione motoria e sullo stato di allerta a dosi effettive, e sembra aver effetti antidolorifici simili al gabapentin[5]. È stato anche studiato per la profilassi degli attacchi maniacali per sostituire l'acido valproico e i suoi derivati, dotati di maggior effetti teratogeni[6].
Effetti collaterali[modifica | modifica wikitesto]
Gli effetti collaterali del valnoctamide sono soprattutto minori e includono sonnolenza[7] e i già citati effetti sulla coordinazione motoria.
Interazioni[modifica | modifica wikitesto]
Il valnoctamide aumenta, mediante inibizione dell'enzima epossido-idrolasi, i livelli del metabolita epossidico della carbamazepina, talvolta fino a livelli tossici[8].
Caratteristiche chimiche[modifica | modifica wikitesto]
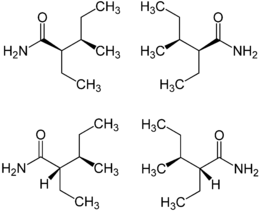
Si tratta di un composto racemico formato da quattro stereoisomeri[9], che si sono dimostrati tutti più efficaci dell'acido valproico nei modelli animali per il trattamento dell'epilessia, in particolar modo il 2S,3S-valnoctamide[10].
Note[modifica | modifica wikitesto]
- ^ (FR) F. M. Harl, Clinical Study Of Valnoctamide On 70 Neuropsychiatric Clinic Patients Undergoing Ambulatory Treatment, in La Presse Médicale, vol. 72, marzo 1964, pp. 753–754, PMID 14119722.
- ^ Abdullah Haj-Yehia, Meir Bialer, Structure-pharmacokinetic relationships in a series of valpromide derivatives with antiepileptic activity, in Pharmaceutical Research, vol. 6, n. 8, agosto 1989, pp. 683–689, DOI:10.1023/A:1015934321764, PMID 2510141.
- ^ (PT) S. Mattos Nda, Use of Valnoctamide (nirvanil) in oligophrenic erethics and epileptics, in Hospital (Rio J), vol. 75, n. 5, maggio 1969, pp. 1701–1704, PMID 5306499.
- ^ H. Lindekens, Ilse Smolders, Ghous M. Khan, Meir Bialer, Guy Ebinger, and Yvette Michotte, In vivo study of the effect of valpromide and valnoctamide in the pilocarpine rat model of focal epilepsy, in Pharmaceutical Research, vol. 17, n. 11, novembre 2000, pp. 1408–1413, DOI:10.1023/A:1007559208599, PMID 11205735.
- ^ Ilan Winkler, Simcha Blotnik, Jakob Shimshoni, Boris Yagen, Marshall Devor, and Meir Bialer, Efficacy of antiepileptic isomers of valproic acid and valpromide in a rat model of neuropathic pain, in British Journal of Pharmacology, vol. 146, n. 2, settembre 2005, pp. 198–208, DOI:10.1038/sj.bjp.0706310, PMC 1576263, PMID 15997234.
- ^ RH Belmaker, Yuly Bersudsky, Alex Mishory and Beersheva Mental Health Center, Valnoctamide in Mania, su ClinicalTrials.gov, United States National Institutes of Health, 2005. URL consultato il 25 febbraio 2006.
- ^ (FR) VALNOCTAMIDE, su biam2.org, BIAM, 2 giugno 1997. URL consultato l'11 gennaio 2012 (archiviato dall'url originale il 13 agosto 2014).
- ^ F Pisani, A Fazio, C Artesi, G Oteri, E Spina, T Tomson e E Perucca, Impairment of carbamazepine-10, 11-epoxide elimination by valnoctamide, a valpromide isomer, in healthy subjects, in British Journal of Clinical Pharmacology, vol. 34, n. 1, 1992, pp. 85–87, PMC 1381382, PMID 1352988.
- ^ Shimon Barel, Boris Yagen, Volker Schurig, Stephan Sobak, Francesco Pisani, Emilio Perucca and Meir Bialer. Stereoselective pharmacokinetic analysis of valnoctamide in healthy subjects and in patients with epilepsy. Clinical Pharmacology & Therapeutics 61, 442–449 (April 1997) DOI: 10.1016/S0009-9236(97)90194-6
- ^ Nina Isoherranen, H. Steve White, Brian D. Klein, Michael Roeder, José H. Woodhead, Volker Schurig, Boris Yagen, Meir Bialer, Pharmacokinetic-pharmacodynamic relationships of (2S,3S)-valnoctamide and its stereoisomer (2R,3S)-valnoctamide in rodent models of epilepsy, in Pharmaceutical Research, vol. 8, n. 8, agosto 2003, pp. 1293–1301, DOI:10.1023/A:1025069519218, PMID 12948028.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Valnoctamide
Wikimedia Commons contiene immagini o altri file su Valnoctamide