Trasposizione allilica: differenze tra le versioni
cat inesistente +avvisi O e F |
|||
| Riga 15: | Riga 15: | ||
==Scopi== |
==Scopi== |
||
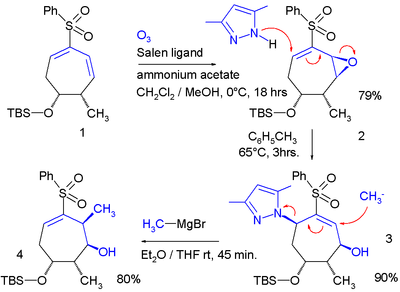
L'utilità della sintesi può essere estesa a sostituzioni sui legami del [[butandiene]]: |
L'utilità della sintesi può essere estesa a sostituzioni sui legami del [[Butadiene|butandiene]]<ref>''Molecular yardsticks. Synthesis of extended equilibrium transfer alkylating cross-link reagents and their use in the formation of macrocycles''Stephen J. Brocchini, Martin Eberle, and Richard G. Lawton [[J. Am. Chem. Soc.]]; '''1988'''; 110(15) pp 5211 - 5212; {{DOI|10.1021/ja00223a061}}</ref>: |
||
:[[Image:Lawton reaction.png|400px|Lawton reaction]] |
:[[Image:Lawton reaction.png|400px|Lawton reaction]] |
||
| Riga 24: | Riga 24: | ||
:[[Image:Double Lawson reaction.png|400px|Double Lawson reaction]] |
:[[Image:Double Lawson reaction.png|400px|Double Lawson reaction]] |
||
==Note== |
|||
<references/> |
|||
{{Portale|chimica}} |
{{Portale|chimica}} |
||
Versione delle 20:02, 25 giu 2014
Il riarrangiamento allilico o trasposizione allilica è una reazione organica nella quale il doppio legame in un composto allilico si trasferisca all'atomo di carbonio successivo. Questo fenomeno si è rilevato nella sostituzione nucleofila.
Nelle condizioni di reazione in cui sia favorito il meccanismo SN1, lo stadio intermedio è un carbocatione, ciò comporta molte possibili strutture di risonanza. Questo spiega la distribuzione del prodotto (product spread) dopo la ricombinazione con il nucleofilo Y. Questo processo è chiamato sostituzione SN1'.
In alternativa è possibile che il nucleofilo attacchi direttamente la posizione allilica, spostando il gruppo uscente in unico passaggio nel processo chiamato sostituzione SN2'. Questo processo si può verificare nella maggior parte dei casi quando l'allile è libero ed è usato un forte nucleofilo. Dalla reazione di 1-cloro-2-butene con idrossido di sodio si ottiene una miscela di 2-buten-1-olo e 1-buten-3-olo:
In un meccanismo di reazione il nucleofilo attacca non direttamente al sito dove si trova l'elettrofilo ma in una addizione coniugata sul doppio legame:
Scopi
L'utilità della sintesi può essere estesa a sostituzioni sui legami del butandiene[1]:
Nel primo passo di questa macrociclizazione il gruppo tiolo in un'estremità del 1,5-pentanoditiolo reagisce con la coda del butadiene in 1 all' enone 2 in un riarrangiamento allilico, con un solfone gruppo uscente che reagisce ulteriormente con l'altra estremità in una reazione di addizione coniugata.
In uno studio lo spostamento allilico è stato applicato due volte in un sistema ad anello:
Note
- ^ Molecular yardsticks. Synthesis of extended equilibrium transfer alkylating cross-link reagents and their use in the formation of macrocyclesStephen J. Brocchini, Martin Eberle, and Richard G. Lawton J. Am. Chem. Soc.; 1988; 110(15) pp 5211 - 5212; DOI: 10.1021/ja00223a061