Difosfano
| Difosfano | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Difosfano | |
| Nomi alternativi | |
| difosfina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | P2H4 |
| Massa molecolare (u) | 65,98 |
| Aspetto | liquido incolore |
| Numero CAS | |
| PubChem | 139283 |
| SMILES | PP |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,014[1] |
| Solubilità in acqua | 0,035 g/100ml a 0 °C |
| Temperatura di fusione | −99 °C (174 K)[1] |
| Temperatura di ebollizione | 63,5 °C (337 K) estrapolato[1] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 20,9 kJ/mol[2] |
| Indicazioni di sicurezza | |
Il difosfano è il composto inorganico di formula P2H4. Questo idruro del fosforo in condizioni normali è un liquido incolore. Il difosfano è l'impurezza che di solito rende infiammabili campioni di fosfano (PH3). Nella vecchia nomenclatura questo composto era chiamato difosfina.
Storia[modifica | modifica wikitesto]
Il difosfano fu preparato per la prima volta da Paul Thénard nel 1844;[3] la sua composizione fu stabilita con certezza solo nel 1936.[4]
Proprietà fisiche[modifica | modifica wikitesto]
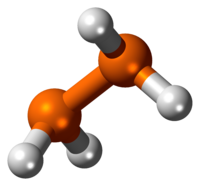
Il difosfano è un liquido incolore spontaneamente infiammabile a contatto con l'aria. È termicamente instabile al di sopra di –30 °C, e la sua decomposizione è accelerata in presenza di luce. A causa dei problemi di decomposizione non è possibile determinarne direttamente la temperatura di ebollizione, che è stata stimata estrapolando i dati di pressione di vapore. Il difosfano è leggermente solubile in acqua, mentre è molto solubile in vari solventi organici tra i quali benzene, toluene, n-esano, cicloesano, etere dietilico, solfuro di carbonio, piridina, triclorometano e tetraclorometano. Misure cristallografiche su polveri sembrano indicare che P2H4 cristallizzi nel sistema monoclino, con costanti di reticolo a = 360 pm, b = 660 pm, c = 520 pm e β = 104°, con due unità di formula per cella elementare. In fase liquida e gassosa la molecola di P2H4 adotta di preferenza una conformazione gauche, con distanze P–P di 221,9 pm e P–H di 145 pm.[2]
Sintesi[modifica | modifica wikitesto]
Il modo migliore per preparare il difosfano è la reazione di idrolisi a freddo del monofosfuro di calcio CaP:
- 2CaP + 4H2O → P2H4 + 2Ca(OH)2
Seguendo una procedura ottimizzata, l'idrolisi di 400 g di CaP con 400 ml di acqua a 20 Torr fornisce circa 20 g di difosfano, leggermente contaminato da fosfano.[2] Alternativamente si può far passare fosfano attraverso una scarica elettrica a 5-10 kV.[1]
Reattività[modifica | modifica wikitesto]
Il difosfano brucia spontaneamente con l'ossigeno dell'aria formando inizialmente pentossido di fosforo e acqua; il prodotto finale è acido fosforico. In presenza di acidi P2H4 dà una reazione di disproporzione e si formano PH3 e prodotti solidi più ricchi di fosforo con composizione varia. Con butillitio si ha pure disproporzione, con formazione di PH3 e prodotti polifosfurati come Li3P7.[2]
Note[modifica | modifica wikitesto]
Bibliografia[modifica | modifica wikitesto]
- (EN) M. Baudler e K. Glinka, Open-Chain Polyphosphorus Hydrides (Phosphanes), in Chem. Rev., vol. 94, n. 5, 1994, pp. 1273-1297, DOI:10.1021/cr00029a005.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) P. Royen e K. Hill, Über einige physikalische und chemische Eigenschaften des flüssigen Phosphorwasserstoffs. (Diphosphin P2H4), in Z. anorg. allg. Chem., vol. 229, n. 2, 1936, pp. 97-111, DOI:10.1002/zaac.19362290202.
- (FR) P. Thenard, Mémoire sur les combinaisons du phosphore avec l'hydrogène, in C. R. Acad. Sci. Paris, vol. 18, 1844, pp. 652-655.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su difosfano
Wikimedia Commons contiene immagini o altri file su difosfano