Cloruro di lantanio(III)
| Cloruro di lantanio(III) | |
|---|---|
 | |
| Nomi alternativi | |
| Tricloruro di lantanio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | LaCl3 |
| Massa molecolare (u) | 245,264 g/mol (anidro) 353,36 g/mol (esaidrato) 371,37 g/mol (eptaidrato) |
| Aspetto | polvere bianca inodore |
| Numero CAS | |
| Numero EINECS | 233-237-5 |
| PubChem | 64735 |
| SMILES | Cl[La](Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/l, in c.s.) | 3.84 g/cm³[1] |
| Solubilità in acqua | 957 g/L (25 °C)[1] |
| Temperatura di fusione | 858 °C |
| Temperatura di ebollizione | 1000 °C |
| Indicazioni di sicurezza | |
Il cloruro di lantanio(III) o tricloruro di lantanio (meno formalmente viene anche chiamato cloruro di lantanio[2]) è un composto inorganico binario del lantanio trivalente con il cloro, avente formula LaCl3. È il sale comune del lantanio con l'acido cloridrico, che viene utilizzato principalmente nella ricerca. È ottenibile in forma di cristalli incolori o polvere bianca; è igroscopico, solubilissimo in acqua e solubile anche in alcoli.[3]
Preparazione e reazioni[modifica | modifica wikitesto]
Si forma per unione degli elementi, ma un metodo più comunemente usato prevede il riscaldamento di una miscela di ossido di lantanio(III) e cloruro di ammonio a 200–250 °C (metodo del cloruro d'ammonio):[4][5][6]
Dal tricloruro si possono produrre gli altri trialogenuri per scambio. La riduzione con potassio dà lantanio metallico.
Usi[modifica | modifica wikitesto]
Un'applicazione del cloruro di lantanio è la rimozione del fosfato dalle soluzioni tramite precipitazione, ad esempio nelle piscine per prevenire la crescita di alghe e altri trattamenti delle acque reflue.[7][8] Si è anche dimostrato il suo uso come coadiuvante di filtraggio e come efficace flocculante. Il cloruro di lantanio viene anche utilizzato nella ricerca biochimica per bloccare l'attività dei canali dei cationi bivalenti, principalmente i canali del calcio. Drogato con cerio, è usato come materiale scintillatore.[9]
Nella sintesi organica, il tricloruro di lantanio funziona come un leggero acido di Lewis per convertire le aldeidi in acetali.[10]
Il composto è stato identificato come un catalizzatore per la clorurazione ossidativa ad alta pressione del metano in clorometano con acido cloridrico e ossigeno.[11]
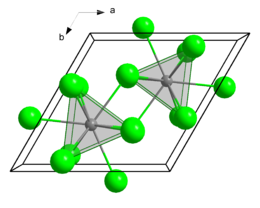
Struttura cristallina[modifica | modifica wikitesto]
Il cloruro di lantanio ha una struttura cristallina esagonale con costanti di reticolo a = 0,74779 nm, c = 0,43745 nm, con due unità formula nella cella elementare. Il suo simbolo di Pearson è hP8 e il suo gruppo spaziale è P63/m (gruppo n° 176).[12] L'eptaidrato (LaCl3·7 H2O) cristallizza invece nel sistema monoclino con parametri a = 1237 pm , b = 1068 pm , c = 923 pm, con un angolo di 114,3°.[13]
Note[modifica | modifica wikitesto]
- ^ a b (EN) Haynes, William M., CRC Handbook of Chemistry and Physics, 92ª ed., CRC Press, 2011, p. 4.69, ISBN 978-14-39-85511-9.
- ^ (EN) PubChem, Lanthanum chloride, su pubchem.ncbi.nlm.nih.gov. URL consultato il 3 aprile 2024.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, p. 949, ISBN 0-7506-3365-4.
- ^ (EN) Brauer, G., Handbook of Preparative Inorganic Chemistry, 2ª ed., New York, Academic Press, 1963.
- ^ (EN) Gerd Meyer, Eduardo Garcia e John D. Corbett, The Ammonium Chloride Route to Anhydrous Rare Earth Chlorides—The Example of Ycl 3, vol. 25, 1ª ed., Wiley, 1989-01, pp. 146–150, DOI:10.1002/9780470132562.ch35, ISBN 978-0-471-61874-4. URL consultato il 3 aprile 2024.
- ^ Synthetic methods of organometallic and inorganic chemistry: Herrmann/Brauer, Georg Thieme Verlag ; Thieme Medical Publishers, 1996, ISBN 978-3-13-103021-4.
- ^ (EN) Masood Ghassemi e Howard Leonard Recht, Phosphate Precipitation with Ferrous Iron, 1971.
- ^ (EN) Water Treatment Chemicals, su americanelements.com, American Elements. URL consultato il 3 agosto 2018.
- ^ (EN) T. Martin, C. Allier e F. Bernard, Lanthanum Chloride Scintillator for X-ray Detection, in AIP Conference Proceedings, vol. 879, 2007, pp. 1156–1159, DOI:10.1063/1.2436269.
- ^ (EN) Lanthanum trichloride: An efficient Lewis acid catalyst for chemo and regioselective enamination of β-dicarbonyl compounds, in Arkivoc, vol. 2007, n. 13, 2007, p. 204, DOI:10.3998/ark.5550190.0008.d23.
- ^ (EN) Podkolzin, S.G., Stangland, E.E., Jones, M.E., Peringer, E. e Lercher, J.A., Methyl chloride production from methane over lanthanum-based catalysts, in J. Am. Chem. Soc., vol. 129, n. 9, 2007, pp. 2569–76, DOI:10.1021/ja066913w.
- ^ (EN) B. Morosin, Crystal Structures of Anhydrous Rare‐Earth Chlorides, in The Journal of Chemical Physics, vol. 49, n. 7, 1968, pp. 3007–3012, DOI:10.1063/1.1670543.
- ^ Jan d' Ans e Jan d' Ans, Elemente, anorganische Verbindungen und Materialien, collana Taschenbuch für Chemiker und Physiker / D'Ans, 4., neubearb. u. rev. Aufl, Verlag nicht ermittelbar, 1998, p. 1463, ISBN 978-3-540-60035-0.
