Inibitore competitivo
Un enzima competitivo è un inibitore enzimatico che segue un meccanismo di inibizione competitiva (reversibile), ovvero compete con il substrato per il legame con il sito attivo dell'enzima.
Meccanismo[modifica | modifica wikitesto]
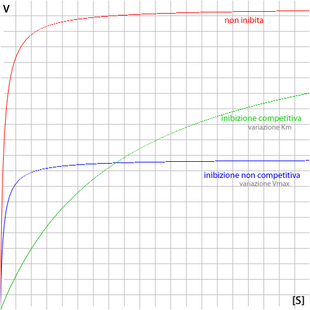
Quando un inibitore competitivo si lega al sito attivo impedisce il legame del substrato. L'effetto è quello di diminuire la concentrazione di enzima libero disponibile a reagire.
All'aumentare della concentrazione di inibitore la km aumenta e quindi diminuisce la velocità della reazione v0. Asintoticamente però la velocità tende ancora a Vmax per cui l'effetto dell'inibitore può essere annullato aumentando la concentrazione di substrato. Infatti si verifica prima il legame enzima-substrato, l'inibitore competitivo perde di efficacia. La consistenza dell'inibizione dipende dunque sia dalla concentrazione di inibitore che da quella di substrato. Spesso gli inibitori competitivi mimano in modo notevole la forma dei substrati di cui inibiscono il legame.
Gli inibitori competitivi spesso sono strutturalmente simili al vero substrato.
Esempi[modifica | modifica wikitesto]
Il metotrexato è un inibitore competitivo della diidrofolato reduttasi, che catalizza la riduzione del diidrofolato a tetraidrofolato.
Bibliografia[modifica | modifica wikitesto]
- David L. Nelson, Michael M. Cox, I Principi di Biochimica di Lehninger, 3ª ed., Bologna, Zanichelli, febbraio 2002, ISBN 88-08-09035-3.
Voci correlate[modifica | modifica wikitesto]
- Inibitore enzimatico
- Inibitore reversibile
- Inibitore irreversibile
- Inibitore non competitivo
- Inibitore acompetitivo
- Inibitore di tipo misto
- Inibizione enzimatica retroattiva da prodotto finale
- Inibitore suicida
- Enzima
- Catalisi enzimatica
- Regolazione allosterica
- Sito attivo
- Cinetica di Michaelis-Menten
- Costante di Michaelis-Menten
Collegamenti esterni[modifica | modifica wikitesto]
- http://www.scibio.unifi.it/triennali/biochem/enzimi/enzymes7.html Archiviato il 24 maggio 2009 in Internet Archive.