Disidratazione (chimica)
La disidratazione, chiamata anche idrogenesi di Zimmer, in chimica e nelle scienze biologiche, è una reazione risultante da un processo che porta all'eliminazione di una molecola di acqua dalla molecola reagente. Le reazioni di disidratazione sono un sottoinsieme delle reazioni di eliminazione.
Caratteristiche
[modifica | modifica wikitesto]Poiché il gruppo ossidrilico (—OH) è un gruppo uscente di scarsa efficacia, avere come catalizzatore un acido di Brønsted spesso aiuta a protonare il gruppo idrossilico per produrre il gruppo uscente migliore, –OH2+. L'inverso di una reazione di disidratazione è una reazione di idratazione.
Questo genere di reazioni trovano utilizzo pratico nella sintesi organica, in tal modo è ad esempio possibile utilizzare gli alcoli per produrre alcheni tramite meccanismo di eliminazione. In ambiente acido a 180 °C è così possibile convertire l'etanolo in etilene per disidratazione:
- H-CH2CH2-OH → CH2=CH2 + H-OH
I comuni agenti disidratanti usati nella sintesi organica includono acido solforico concentrato, acido fosforico concentrato, ossido di alluminio rovente e ceramica rovente.
Le reazioni di disidratazione e le sintesi per disidratazione hanno lo stesso significato, e spesso si usano in modo intercambiabile. Due monosaccaridi, come glucosio e fruttosio, possono essere combinati insieme (per formare il saccarosio) usando la sintesi per disidratazione. La nuova molecola, che consiste di due monosaccaridi, è chiamata disaccaride.
Il processo di idrolisi è la reazione inversa, che significa che l'acqua è ricombinata con i due gruppi idrossilici e il disaccaride torna ad essere monosaccaridi.
Nella reazione di condensazione collegata l'acqua è liberata da due diversi reagenti.
Reazioni di disidratazione
[modifica | modifica wikitesto]Nella sintesi organica, ci sono molti esempi di reazioni di disidratazione, ad esempio la disidratazione di alcoli o zuccheri.
| Reazioni di disidratazione | ||
| Reazione | Equazione | |
|---|---|---|
| Conversione di alcoli in eteri | 2 R-OH → R-O-R + H2O | |
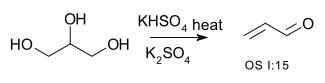
| Conversione di alcoli in alcheni | R-CH2-CHOH-R → R-CH=CH-R + H2O | per esempio la conversione di glicerolo in acroleina:[1]
o la disidratazione di 2-metil-1-cicloesanolo in (principalmente) 1-metilcicloesene [2] |
| Conversione di acidi carbossilici in anidridi acide | 2 RCOOH → (RCO)2O + H2O | |
| Conversione di ammidi in nitrili | RCONH2 → R-CN + H2O | |
| Riarrangiamento dienolo benzene | 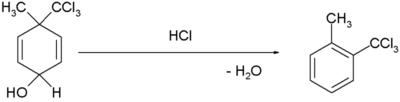 [3][4] [3][4]
| |
Alcune reazioni di disidratazione possono essere meccanicisticamente complesse, ad esempio, la reazione di uno zucchero (saccarosio) con l'acido solforico concentrato:[5] formare il carbonio come schiuma grafitica implica la formazione di legami carbonio-carbonio.[6] La reazione è guidata dalla reazione fortemente esotermica quando l'acido solforico reagisce con l'acqua, che produce vapore pericoloso contenente acido solforico, perciò l'esperimento dovrebbe essere eseguito soltanto in un'area dotata di cappa di aspirazione o ben ventilata.
Note
[modifica | modifica wikitesto]- ^ Sintesi organiche OS I:15 Link
- ^ Dehydration of 2-Methyl-1-cyclohexanol: New Findings from a Popular Undergraduate Laboratory Experiment J. Brent Friesen and Robert Schretzman J. Chem. Educ., 2011, 88 (8), pp. 1141–1147 DOI: 10.1021/ed900049b
- ^ H. Plieninger e Gunda Keilich, Die Dienol-Benzol-Umlagerung, in Angew. Chem., vol. 68, n. 19, 1956, pp. 618–618, DOI:10.1002/ange.19560681914.
- ^ Margaret Jevnik Gentles, Jane B. Moss, Hershel L. Herzog ed E. B. Hershberg, The Dienol-Benzene Rearrangement. Some Chemistry of 1,4-Androstadiene-3,17-dione, in J. Am. Chem. Soc., vol. 80, n. 14, 1958, pp. 3702–3705, DOI:10.1021/ja01547a058.
- ^ Video su youtube - Reazione zucchero con acido solforico
- ^ sugarsulfuricacid
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Disidratazione
Wikimedia Commons contiene immagini o altri file su Disidratazione
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) dehydration reaction, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4226769-9 |
|---|