Reazione di Barbier

La reazione di Barbier è una reazione in chimica organica tra un alogenuro alchilico e un gruppo carbonilico (che fa da substrato elettrofilo) in presenza di magnesio, zinco, alluminio, indio oppure sali di stagno. Il prodotto è un alcol primario, secondario o terziario (dipende dal reagente iniziale). Fu sviluppata da Philippe Barbier, insegnante di Victor Grignard.
Questo processo è molto simile alla reazione di Grignard ma la differenza sostanziale sta nel fatto che il metodo di Barbier sfrutta un solo ambiente di reazione, per cui il reattivo di Grignard deve essere preparato separatamente prima di essere aggiunto al composto carbonilico.[1]
La reazione di Barbier è da considerarsi un'addizione nucleofila che di solito si svolge con metalli poco costosi e non danneggiati dall'acqua oppure con composti metallici, a differenza dell'impiego di reattivi di Grignard o composti di organo-litio. Per questa ragione in molti casi è possibile far avvenire la reazione direttamente in acqua (con i composti organometallici non va bene dato che in acqua si dissociano, in particolare i composti di organolitio danno reazioni esplosive). Il fatto di poter impiegare l'acqua come solvente rende questa reazione ecologica e si parla di green chemistry.
La reazione di Barbier è, infine, classificabile come una reazione di accoppiamento chimico.
Esempi[modifica | modifica wikitesto]
Ecco alcuni esempi di reazione di Barbier.
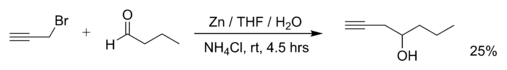
- Reazione del bromuro propargilico con butanale e zinco metallico in acqua:[2]
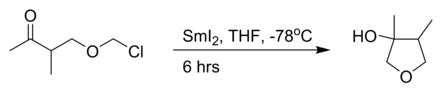
- Una Barbier intramolecolare con lo ioduro di samario (II):[3]
- La reazione di un bromuro allilico con formaldeide e polvere di indio in THF:[4]

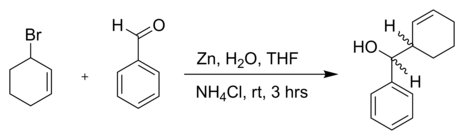
- Un altro bromuro allilico con benzaldeide e polvere di zinco in acqua:[5]
Varianti asimmetriche[modifica | modifica wikitesto]
La sintesi della (+)aspicillina inizia prima con un'idroborazione e poi con una transmetallazione dello zinco che può poi dare un'addizione al sostituente aldeidico.[6]

Note[modifica | modifica wikitesto]
- ^ P. Barbier, Synthèse du diéthylhepténol, in Compt. Rend., vol. 128, 1899, p. 110.
- ^ Artur Jõgi e Uno Mäeorg, Zn Mediated Regioselective Barbier Reaction of Propargylic Bromides in THF/aq. NH4Cl Solution (PDF), in Molecules, vol. 6, n. 12, 2001, pp. 964-968, DOI:10.3390/61200964, ISSN 1420-3049.
- ^ Tore Skjæret e Tore Benneche, Preparation of oxo-substituted α-chloro ethers and their reaction with samarium diiodide, in Arkivoc, 2001, pp. KU–242A.
- ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=v77p0107.
- ^ Gary W. Breton, John H. Shugart, Christine A. Hughey, Brian P. Conrad e Suzanne M. Perala, Use of Cyclic Allylic Bromides in the Zinc–Mediated Aqueous Barbier–Grignard Reaction (PDF), in Molecules, vol. 6, n. 8, 2001, pp. 655-662, DOI:10.3390/60800655.
- ^ De Brabander,J;et al. Tetrahedron Letters, 1995, Vol. 36, No. 15, pp. 2607-2610
Bibliografia[modifica | modifica wikitesto]
- (EN) Cornelis Blomberg, The Barbier Reaction and Related One-Step Processes, collana Reactivity and Structure: Concepts in Organic Chemistry, Springer, Berlin, Heidelberg, 1993, pp. 137-165, DOI:10.1007/978-3-642-85019-6_4, ISBN 978-3-642-85021-9. URL consultato l'8 aprile 2018.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Reazione di Barbier
Wikimedia Commons contiene immagini o altri file su Reazione di Barbier
Collegamenti esterni[modifica | modifica wikitesto]
- La reazione di Barbier spiegata sul sito della University of Connecticut, su orgchem.chem.uconn.edu. URL consultato l'8 aprile 2018 (archiviato dall'url originale l'11 ottobre 2009).
- Spiegazione dettagliata, su link.springer.com.