Ossigeno solido
L'ossigeno solido si forma a pressione normale ad una temperatura inferiore a 54,36 K (−218,79 °C). Come l'ossigeno liquido, l'ossigeno solido O2 è una sostanza di colore azzurro.
L'ossigeno molecolare O2 è l'unica molecola diatomica (e una delle poche molecole in generale) a possedere un momento magnetico;[1] per questo motivo, l'ossigeno solido ha suscitato particolare interesse per lo studio sulla relazione tra magnetizzazione molecolare e struttura cristallina, struttura elettronica e superconduttività. A pressioni elevate, l'ossigeno solido passa da uno stato di isolante ad uno stato metallico,[2] e a temperature molto basse diventa un superconduttore.[3] Fino ad oggi sono state scoperte sei fasi cristallografiche distinte dell'ossigeno solido.
Il volume molare dell'ossigeno solido va da un minimo di 21 cm³/mol per la fase α, a un massimo di 23,5 cm³/mol per la fase γ.[4]
Fasi cristalline[modifica | modifica wikitesto]

Attualmente si conoscono sei fasi cristallografiche dell'ossigeno solido:[1][5]
- Ossigeno-α: azzurro — si forma a 1 atm sotto i 23,8 K; struttura cristallina monoclina.
- Ossigeno-β: azzurro-rosa — si forma a 1 atm sotto i 43,8 K; struttura cristallina romboedrica.
- Ossigeno-γ: azzurro pallido — si forma a 1 atm sotto i 54,36 K; struttura cristallina cubica.
- Ossigeno-δ: arancione — si forma a temperatura ambiente ad una pressione di 9 GPa
- Ossigeno-ε: rosso scuro — si forma a temperatura ambiente a pressioni superiori a 10 GPa
- Ossigeno-ζ: metallico — si forma a pressioni superiori a 96 GPa
Ossigeno rosso[modifica | modifica wikitesto]
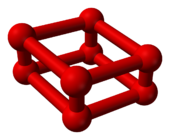
Sottoponendo l'ossigeno a pressioni superiori a 10 GPa a temperatura ambiente, questo subisce una transizione di fase ad un differente allotropo; il suo volume diminuisce drasticamente[6] e passa da un colore blu a rosso scuro.[7] La struttura molecolare dell'ossigeno-ε, scoperto nel 1979, è ancora incerta; tuttavia, nel 2006, per mezzo della cristallografia a raggi X, è stato dimostrato che essa consiste in un cluster O8[8][9][10] composto da quattro molecole di ossigeno O2, contrariamente a quanto ipotizzato nel 1999 da uno studio del suo spettro di assorbimento infrarosso che prediceva una struttura O4 in un reticolo cristallino.[11]
Struttura molecolare dell' O8 |
Struttura cristallina dell'ossigeno-ε
|
L'ossigeno rosso presenta una simmetria monoclina C2/m.
Ossigeno metallico[modifica | modifica wikitesto]
Comprimendo ulteriormente la fase ε fino a raggiungere i 96 GPa di pressione, è possibile ottenere l'ossigeno metallico, o ossigeno-ζ.[6] Questa fase metallica, scoperta nel 1990 sottoponendo l'ossigeno a 132 GPa,[2] è in grado di esibire superconduttività a pressioni superiori i 100 GPa e a temperature inferiori a 0,6 K.[3][5]
Note[modifica | modifica wikitesto]
- ^ a b Yu.A. Freiman e H.J. Jodl, Solid oxygen, in Physics Reports, vol. 401, n. 1-4, pp. 1-228, DOI:10.1016/j.physrep.2004.06.002. URL consultato il 10 febbraio 2018.
- ^ a b Serge. Desgreniers, Yogesh K. Vohra e Arthur L. Ruoff, Optical response of very high density solid oxygen to 132 GPa, in The Journal of Physical Chemistry, vol. 94, n. 3, 8 febbraio 1990, pp. 1117-1122, DOI:10.1021/j100366a020. URL consultato il 10 febbraio 2018.
- ^ a b K. Shimizu, K. Suhara e M. Ikumo, Superconductivity in oxygen, in Nature, vol. 393, 1º giugno 1998, pp. 767-769, DOI:10.1038/31656. URL consultato il 10 febbraio 2018.
- ^ H. M. Roder, The molar volume (density) of solid oxygen in equilibrium with vapor, in Journal of Physical and Chemical Reference Data, vol. 7, 1º luglio 1978, pp. 949-958, DOI:10.1063/1.555582. URL consultato il 10 febbraio 2018.
- ^ a b (EN) Solid Oxygen e-Phase Crystal Structure Determined Along With The Discovery of a Red Oxygen O8 Cluster, su AZoNano.com, 4 dicembre 2006. URL consultato il 10 febbraio 2018.
- ^ a b Yuichi Akahama, Haruki Kawamura e Daniel Häusermann, New High-Pressure Structural Transition of Oxygen at 96 GPa Associated with Metallization in a Molecular Solid, in Physical Review Letters, vol. 74, n. 23, 5 giugno 1995, pp. 4690-4693, DOI:10.1103/PhysRevLett.74.4690. URL consultato il 10 febbraio 2018.
- ^ Malcolm Nicol, K. R. Hirsch e Wilfried B. Holzapfel, Oxygen phase equilibria near 298 K, in Chemical Physics Letters, vol. 68, 1º dicembre 1979, pp. 49-52, DOI:10.1016/0009-2614(79)80066-4. URL consultato il 10 febbraio 2018.
- ^ Hiroshi Fujihisa et al., O8 Cluster Structure of the Epsilon Phase of Solid Oxygen, in Physical Review Letters, vol. 97, n. 8, 2006, p. 085503, DOI:10.1103/PhysRevLett.97.085503. URL consultato il 10 febbraio 2018.
- ^ Lars F. Lundegaard, Gunnar Weck e Malcolm I. McMahon, Observation of an O8 molecular lattice in the ε phase of solid oxygen, in Nature, vol. 443, 1º settembre 2006, pp. 201-204, DOI:10.1038/nature05174. URL consultato il 10 febbraio 2018.
- ^ (EN) Ralf Steudel e Ming Wah Wong, Dark-Red O8 Molecules in Solid Oxygen: Rhomboid Clusters, Not S8-Like Rings, in Angewandte Chemie International Edition, vol. 46, n. 11, 5 marzo 2007, pp. 1768-1771, DOI:10.1002/anie.200604410/abstract. URL consultato il 10 febbraio 2018.
- ^ Federico A. Gorelli, Lorenzo Ulivi e Mario Santoro, The ε Phase of Solid Oxygen: Evidence of an O4 Molecule Lattice, in Physical Review Letters, vol. 83, n. 20, 15 novembre 1999, pp. 4093-4096, DOI:10.1103/PhysRevLett.83.4093. URL consultato il 10 febbraio 2018.