Omoaromaticità
L'omoaromaticità in chimica organica è un caso particolare di aromaticità dove la normale coniugazione è interrotta dalla presenza di uno o più singoli atomi di carbonio ibridati sp3. I composti che contengono questo tipo di legame aromatico sono detti composti omoaromatici. La presenza di un centro sp3 interrompe la sovrapposizione tra orbitali p di atomi contigui tradizionalmente richiesta per avere un composto aromatico, tuttavia i composti omoaromatici possiedono una notevole stabilità termodinamica e molte proprietà spettroscopiche, magnetiche e chimiche tipiche di composti aromatici, indicando che la sovrapposizione degli orbitali p riesce apparentemente a superare il centro sp3 formando comunque un ciclo continuo di elettroni π.[1]

Il concetto di omoaromaticità fu introdotto da Saul Winstein nel 1959 con i suoi studi sul catione tris-omociclopropenile.[2] Da allora ci sono stati molti studi su queste specie; si conoscono composti omoaromatici sia cationici che anionici, mentre le molecole neutre sembrano meno comuni.[3][4] Il catione "omotropilio" (C8H9+) è uno dei più studiati composti omoaromatici.
Nomenclatura
[modifica | modifica wikitesto]Il termine "omoaromaticità" deriva dalla somiglianza di struttura tra i composti omoaromatici e gli analoghi composti aromatici.[2] La nomenclatura IUPAC richiede di usare i prefissi bis-, tris-, ecc. per descrivere i composti omoaromatici che contengono due, tre, ecc. centri sp3 separati che interrompono la coniugazione del sistema aromatico.
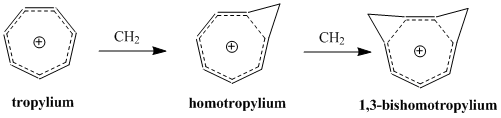
Storia
[modifica | modifica wikitesto]Il concetto di omoaromaticità nasce dal dibattito svoltosi negli anni cinquanta sulla struttura di carbocationi non classici (tetra o pentacoordinati) a confronto con i classici carbocationi trivalenti.[5] Saul Winstein, sostenitore del modello non classico, fu il primo a descrivere l'omoaromaticità studiando il catione 3-biciclo[3.1.0]esile.

In una serie di esperimenti di acetolisi, Winstein e collaboratori osservarono che la reazione di solvolisi era più veloce quando il gruppo uscente tosilato era in posizione equatoriale. La differente velocità di reazione venne attribuita all'assistenza anchimerica invocata dall'isomero "cis". Questo risultato supportava una struttura non-classica del catione.[6]
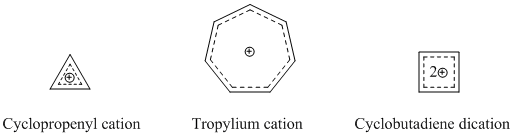
In seguito Winstein osservò che questo modello non classico del catione 3-biciclo[3.1.0]esile lo rende simile al ben noto catione aromatico ciclopropenile. Come nel catione ciclopropenile, la carica positiva è delocalizzata su tre atomi di carbonio equivalenti che contengono due elettroni π. Questa configurazione elettronica soddisfa la regola di Hückel per l'aromaticità, dato che sono richiesti 4n+2 elettroni π. Winstein notò che la sola differenza fondamentale tra il catione propenilico aromatico e il catione non classico esile stava nel fatto che nel secondo caso la coniugazione era interrotta da tre unità CH2. Fu quindi proposto il nome "tris-omociclopropenile" per il corrispondente tris-omo del catione ciclopropenile.
Esempi di composti omoaromatici
[modifica | modifica wikitesto]Dopo la scoperta dei primi composti omoaromatici i ricercatori hanno continuato a sintetizzare nuovi composti omoaromatici che possiedono una stabilità simile ai composti progenitori aromatici. Esistono varie classi di composti omoaromatici, previste in linea teorica e ottenute sperimentalmente.
Cationi omoaromatici
[modifica | modifica wikitesto]I cationi omoaromatici sono le specie omoaromatiche più note e affermate. Come già detto, il catione omotropilio è uno dei più conosciuti e studiati. Molti composti cationici omoaromatici si basano sui cationi ciclopropenile, tropilio o ciclobutadiene, dato che questi composti hanno un forte carattere aromatico.
Un'altra specie ben nota è il catione norbornen-7-ile, le cui proprietà omoaromatiche sono state provate sia teoricamente che sperimentalmente.[7]

Un caso intrigante di bis-omoaromaticità σ è rappresentato dai dicationi dei pagodani. In questi sistemi a 4 centri e 2 elettroni la delocalizzazione è situata nel piano definito dai quattro atomi di carbonio al centro della struttura. (Il ciclopropano è un prototipo di aromaticità σ e guadagna circa 11,3 kcal/mol da questo effetto.[8]) I dicationi si possono ottenere o per ossidazione del pagodano o per ossidazione del corrispondente bis-seco-dodecaedradiene:[9]
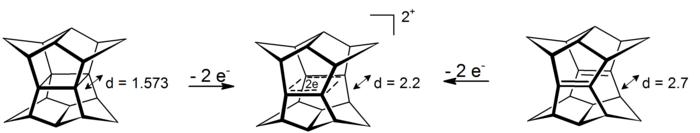
Specie omoaromatiche neutre
[modifica | modifica wikitesto]Ci sono molte classi di composti omoaromatici neutri, ma è molto dibattuto se mostrino o meno un vero carattere omoaromatico. La classe più semplice è quella dei mono-omoaromatici; uno dei più semplici è il cicloeptatriene. Esistono numerosi mono-omoaromatici più complessi. Un esempio particolare è un derivato del C60 contenente un singolo ponte metilenico. Le analisi UV e NMR hanno mostrato che il carattere aromatico di questa specie non è distrutto dall'addizione di un legame omoconiugato, e quindi il composto è decisamente omoaromatico.[10]
Bis-omoaromatici
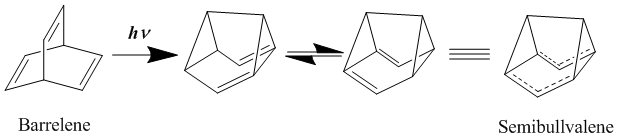
[modifica | modifica wikitesto]Si è a lungo ritenuto che i migliori esempi di omoaromatici neutri siano composti bis-omoaromatici quali barrelene e semibullvalene. Quest'ultimo fu sintetizzato per la prima volta nel 1966.[11] Il semibullvalene ha una struttura che dovrebbe prestarsi bene all'omoaromaticità, anche se è stato molto dibattuto se i derivati del semibullvalene abbiano veramente una delocalizzazione che li classifichi come omoaromatici neutri allo stato fondamentale. Si è tentato di stabilizzare ulteriormente la struttura di transizione delocalizzata utilizzando gruppi elettron donatori o accettori, trovando che la barriera di attivazione al riarrangiamento può essere abbassata ma non eliminata.[12][13] Una vera struttura delocalizzata omoaromatica allo stato fondamentale è stata ottenuta introducendo tensione negli anelli in modo da destabilizzare lo stato fondamentale delle strutture localizzate.[14]
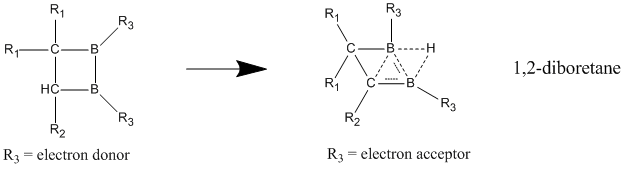
Altri composti considerati omoaromatici neutri sono i 1,2-diboretani e relativi derivati. In questi composti contenenti boro lo stato delocalizzato è molto più stabilizzato dello stato localizzato, suggerendo l'omoaromaticità del composto.[15] Attaccando gruppi elettron-donatori ai due atomi di boro si favorisce il modello classico con legami localizzati. Il carattere omoaromatico è più evidente attaccando gruppi elettron-accettori agli atomi di boro; in questo caso il composto adotta una struttura delocalizzata non classica.
Tris-omoaromatici
[modifica | modifica wikitesto]Come indica il nome, questi composti contengono tre ponti metilenici che interrompono la coniugazione del sistema aromatico. Come nel caso del semibullvalene, è molto dibattuto quanto questi composti siano effettivamente omoaromatici. In teoria sono omoaromatici, ma la delocalizzazione porta ad una stabilizzazione che non supera il 5% di quella del benzene.[16]
Anioni omoaromatici
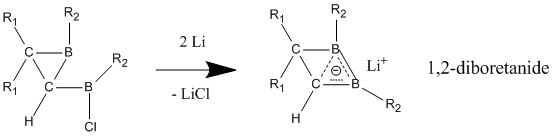
[modifica | modifica wikitesto]A differenza degli omoaromatici neutri, gli omoaromatici anionici sono comunemente considerati "veri" omoaromatici. Questi composti anionici si preparano in genere dai composti progenitori neutri per riduzione con litio metallico. I derivati del 1,2-diboretanuro hanno un forte carattere omoaromatico nel loro legame a due elettroni su tre atomi (boro, boro, carbonio); i legami C–B risultano più corti che nella corrispondente specie neutra classica.[17] In questi 1,2-diboretanuri l'anello può essere espanso con diversi sostituenti continuando a mantenere un certo grado di omoaromaticità.
Altri anioni omoaromatici sono i dianioni di composti bis-diazene, che contengono un ciclo a quattro atomi (i quattro azoti) con sei elettroni. Sperimentalmente si è osservato l'accorciamento della distanza transannulare azoto-azoto, dimostrando che questi bis-diazeni dianionici sono anioni bis-omoaromatici. Una caratteristica peculiare di questi sistemi è che il ciclo elettronico delocalizzato è nel piano σ definito dai quattro azoti. Queste specie sono quindi i primi esempi di bis-omoaromaticità σ a 4 centri e 6 elettroni.[18][19]
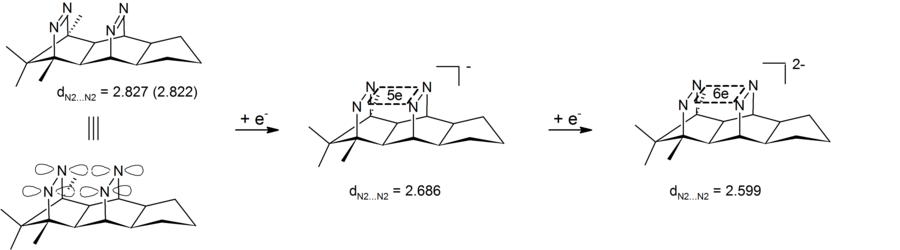
Omoantiaromaticità
[modifica | modifica wikitesto]Sono noti anche casi di composti omoantiaromatici, così come esistono composti aromatici e composti antiaromatici. (I composti aromatici mostrano una stabilità eccezionale, mentre i composti antiaromatici sono relativamente instabili, dato che hanno un ciclo con 4n elettroni π delocalizzati e dunque deviano dalla regola di Hückel.) Il catione biciclo[3.2.1]octa-3,6-dien-2-ile contiene solo 4 elettroni π e quindi è "bis-omoantiaromatico". Calcoli teorici confermano che questo catione è meno stabile del corrispondente catione allilico.[20]
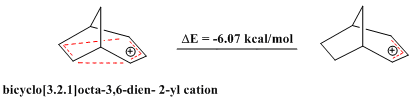
In modo analogo, calcoli teorici e analisi NMR hanno mostrato che il catione 2-(4'-fluorofenil) biciclo[3.2.1]octa-3,6-dien-2-ile è omoantiaromatico rispetto al corrispondente catione allilico.[20]

Note
[modifica | modifica wikitesto]- ^ McNaught e Wilkinson
- ^ a b Winstein 1959
- ^ Williams 2001
- ^ Freeman 2005
- ^ Olah 1972
- ^ Winsteinet al. 1959
- ^ Carey e Sundberg 2000
- ^ Exner e von Ragué Schleyer 2001
- ^ Prinzbach et al. 1995
- ^ Suzuki et al. 1992
- ^ Zimmerman e Grunewald
- ^ Dewar e Lo 1971
- ^ Hoffmann e Stohrer
- ^ Griffiths et al. 2011
- ^ Steiner et al. 1994
- ^ Martin e Mayer
- ^ Steiner et al. 1996
- ^ Exner et al. 1998
- ^ Exner et al. 2000
- ^ a b Volz e Shin
Bibliografia
[modifica | modifica wikitesto]- (EN) F.A. Carey e R.J. Sundberg, Advanced Organic Chemistry: Part A: Structure and Mechanism, New York, Kluwer Academic/Plenum Publishers, 2000, pp. 327-334, ISBN 978-0-387-68346-1.
- (EN) M. J. S. Dewar e D. H. Lo, Ground states of .sigma.-bonded molecules. XIV. Application of energy partitioning to the MINDO/2 method and a study of the Cope rearrangement, in J. Am. Chem. Soc., vol. 93, n. 26, 1971, pp. 7201–7207, DOI:10.1021/ja00755a014.
- (EN) K. Exner, D. Hunkler, G. Gescheidt e H. Prinzbach, <1910::AID-ANIE1910>3.0.CO;2-D Do Nonclassical, Cyclically Delocalized 4N/5e Radical Anions and 4N/6e Dianions Exist? – One- and Two-Electron Reduction of Proximate, Synperiplanar Bis-Diazenes, in Angew. Chem. Int. Ed. Engl., vol. 37, n. 13-14, 1998, pp. 1910–1913, DOI:10.1002/(SICI)1521-3773(19980803)37:13/14<1910::AID-ANIE1910>3.0.CO;2-D.
- (EN) K. Exner, O. Cullmann, M. Vögtle, H. Prinzbach e altri, Cyclic In-Plane Electron Delocalization (σ-Bishomoaromaticity) in 4N/5e Radical Anions and 4N/6e Dianions – Generation, Structures, Properties, Ion-Pairing, and Calculations, in J. Am. Chem. Soc., vol. 122, n. 43, 2000, pp. 10650–10660, DOI:10.1021/ja0014943.
- (EN) K. Exner e P. von Ragué Schleyer, Theoretical Bond Energies: A Critical Evaluation, in J. Phys. Chem. A, vol. 105, n. 13, 2001, pp. 3407–3416, DOI:10.1021/jp004193o.
- (EN) P. K. Freeman, Neutral Homoaromaticity in Some Heterocyclic Systems, in J. Org. Chem., vol. 70, n. 6, 2005, pp. 1998–2001, DOI:10.1021/jo040250o.
- (EN) P. R. Griffiths, D. E. Pivonka e R. V. Williams, The Experimental Realization of a Neutral Homoaromatic Carbocycle, in Chem. Eur. J., vol. 17, n. 33, 2011, pp. 9193–9199, DOI:10.1002/chem.201100025.
- (EN) R. Hoffmann e W. D. Stohrer, Cope rearrangement revisited, in J. Am. Chem. Soc., vol. 93, n. 25, 1971, pp. 6941–6948, DOI:10.1021/ja00754a042.
- (EN) H.D. Martin e B. Mayer, Proximity Effects in Organic Chemistry? The Photoelectron Spectroscopic Investigation of Non-Bonding and Transannular Interactions, in Angew. Chem. Int. Ed. Engl., vol. 22, n. 4, 1983, pp. 283–314, DOI:10.1002/anie.198302831.
- A. D. McNaught e A. Wilkinson, homoaromatic, su IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"), Blackwell Scientific Publications, 2006. URL consultato il 5 febbraio 2017.
- (EN) G. A. Olah, Stable carbocations. CXVIII. General concept and structure of carbocations based on differentiation of trivalent (classical) carbenium ions from three-center bound penta- of tetracoordinated (nonclassical) carbonium ions. Role of carbocations in electrophilic reactions, in J. Am. Chem. Soc., vol. 94, n. 3, 1972, pp. 808–820, DOI:10.1021/ja00758a020.
- (EN) H. Prinzbach, G. Gescheidt, H.-D. Martin, R . Herges e altri, Cyclic electron delocalization in hydrocarbon cages: Pagodanes, isopagodanes, (bisseco/seco-)dodecahedradienes, in Pure Appl. Chem., vol. 67, n. 5, 1995, pp. 673–682, DOI:10.1351/pac199567050673.
- (EN) D. Steiner, C. Balzereit, H. J. R. Winkler, N. Stamatis e altri, Nonclassical 1,2-Diboretanes and 1,2-Diborolanes, in Angew. Chem. Int. Ed. Engl., vol. 33, n. 22, 1994, pp. 2303–2306, DOI:10.1002/anie.199423031.
- (EN) D. Steiner, H. Winkler, C. Balzereit, T. Happel e altri, 1,2-Diboretanides: Homoaromatic 2π-Electron Compounds with High Inversion Barriers, in Angew. Chem. Int. Ed. Engl., vol. 35, n. 17, 1996, pp. 1990–1992, DOI:10.1002/anie.199619901.
- (EN) T. Suzuki, Q. Li, K. C. Khemani e F. Wudl, Dihydrofulleroid H3C61: synthesis and properties of the parent fulleroid, in J. Am. Chem. Soc., vol. 114, n. 18, 1992, pp. 7301–7302, DOI:10.1021/ja00044a055.
- (EN) H. Volz e J. Shin, Bicyclo[3.2.1]octa-3,6-dien-2-yl Cation: A Bishomoantiaromate, in J. Org. Chem., vol. 71, n. 6, 2006, pp. 2220–2226, DOI:10.1021/jo0515125.
- (EN) R. V. Williams, Homoaromaticity, in Chem. Rev., vol. 101, n. 5, 2001, pp. 1185–1204, DOI:10.1021/cr9903149.
- (EN) S. Winstein, Homo-aromatic structures, in J. Am. Chem. Soc., vol. 81, n. 24, 1959, pp. 6524–6525, DOI:10.1021/ja01533a052.
- (EN) S. Winstein, J. Sonnenberg e L. De Vries, The tris-homocyclopropenyl cation., in J. Am. Chem. Soc., vol. 81, n. 24, 1959, pp. 6523–6524, DOI:10.1021/ja01533a051.
- (EN) H. E. Zimmerman e G. L. Grunewald, The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene, in J. Am. Chem. Soc., vol. 88, n. 1, 1966, pp. 183–184, DOI:10.1021/ja00953a045.