Oleandrina
Vai alla navigazione
Vai alla ricerca
| Oleandrina | |
|---|---|
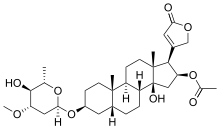 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C32H48O9 |
| Massa molecolare (u) | 576,72 |
| Numero CAS | |
| Numero EINECS | 207-361-5 |
| PubChem | 11541511 |
| DrugBank | DB12843 |
| SMILES | CC1C(C(CC(O1)OC2CCC3(C(C2)CCC4C3CCC5(C4(CC(C5C6=CC(=O)OC6)OC(=O)C)O)C)C)OC)O |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 300 - 330 - 373 |
| Consigli P | 260 - 264 - 284 - 301+310 - 310 [1] |
L'oleandrina è un glucoside cardiotonico che viene prodotto dal Nerium oleander. Insieme alla neandrina è l'agente responsabile della velenosità della linfa dell'oleandro.
L'ingestione dell'oleandrina può causare effetti gastrointestinali e cardiaci. Gli effetti gastrointestinali consistono in nausea e vomito, eccesso di salivazione, dolore addominale e diarrea. Gli effetti cardiaci sono invece più pericolosi: andando ad interferire con l'attività dei canali del calcio va ad alterare il normale flusso di ioni attraverso la membrana cellulare. L'anormale concentrazione all'interno delle cellule cardiache causa irregolarità nella pulsazione cardiaca, aritmia ed arresto cardiaco.
Note[modifica | modifica wikitesto]
- ^ Sigma Aldrich; rev. del 21.12.2011
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su oleandrina
Wikimedia Commons contiene immagini o altri file su oleandrina
| Controllo di autorità | Thesaurus BNCF 24898 |
|---|