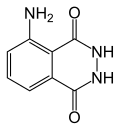
Luminol
| Luminol | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 5-ammino-2,3-diidro-1,4-ftalazindione | |
| Nomi alternativi | |
| o-amminoftaloil idrazina o-amminoftalil idrazina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C8H7N3O2 |
| Peso formula (u) | 177,16 |
| Aspetto | solido granuloso giallo |
| Numero CAS | |
| Numero EINECS | 208-309-4 |
| PubChem | 10638 |
| SMILES | C1=CC2=C(C(=C1)N)C(=O)NNC2=O |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | < 1 g/L |
| Temperatura di fusione | 320 °C (583 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 315 - 319 - 335 |
| Consigli P | 261 - 305+351+338 [1] |
Il luminol o luminolo[2] (nome IUPAC 5-ammino-2,3-diidro-1,4-ftalazindione) è un composto chimico utilizzato dalla Polizia Scientifica per rilevare il sangue, dai chimici e biochimici per la ricerca di rame, ferro e cianuro, e per permettere l'identificazione di specifiche proteine separate mediante elettroforesi.
È una sostanza molto versatile che, mischiata con un appropriato agente ossidante, esibisce una chemiluminescenza bluastra. È un solido cristallino bianco o leggermente giallino solubile nella maggior parte dei solventi organici anche di uso comune, ma è insolubile nell'acqua.
Sintesi[modifica | modifica wikitesto]
Il Luminol può essere sintetizzato a partire dall'acido 3-nitroftalico.[3][4] All'inizio si riscaldano idrazina (N2H4) e acido 3-nitroftalico in un solvente altobollente come il glicerolo (1,2,3-propantriolo). Avviene una reazione di condensazione con perdita di acqua e formazione di 3-nitroftalidrazide. Il nitrogruppo viene quindi ridotto a gruppo amminico con ditionito di sodio (Na2S2O4) portando al Luminol.
Chemiluminescenza[modifica | modifica wikitesto]

Per esibire la sua luminescenza, il Luminol deve prima essere attivato con un ossidante. Solitamente una soluzione di perossido di idrogeno H2O2 ed un sale basico in acqua sono usati come attivatori. In presenza di catalizzatori come i composti del ferro, il perossido di idrogeno si decompone in acqua e ossigeno:
Nella pratica di laboratorio il catalizzatore più usato è il ferrocianuro di potassio. Nella ricerca forense del sangue il catalizzatore è invece il ferro presente nell'emoglobina. Anche molti enzimi biologici possono catalizzare la decomposizione del perossido di idrogeno. Quando il Luminol reagisce con un sale basico si forma un dianione che reagisce con l'ossigeno prodotto dalla decomposizione del perossido. Il prodotto di questa reazione è un perossido organico molto instabile che decompone immediatamente, con perdita di azoto, per formare acido 5-amminiftalico con elettroni in uno stato eccitato. Tornando allo stato fondamentale, l'eccesso di energia è liberato come fotone, visibile come una luce blu.

Applicazioni[modifica | modifica wikitesto]
Viene utilizzato come reagente generico per indurre la luminescenza a scopi ludici o scientifici e nel campo medico per condurre prove biochimiche.
Campo investigativo[modifica | modifica wikitesto]
Il Luminol è utilizzato dalla polizia scientifica per determinare e rilevare tracce di sangue, anche lavato o rimosso. Usando la proprietà chimica della luminescenza, esso emette luce reagendo con il perossido di idrogeno. Il ferro presente nell'emoglobina del sangue agisce da catalizzatore nella luminescenza. Il colore del Luminol che reagisce è blu e dura circa 30 secondi e necessita, per essere rilevato, della quasi oscurità.
- In ambiente alcalino reagisce con l'acqua ossigenata H2O2 e esacianoferrato (III) di potassio K3[Fe(CN)6], emettendo luce.
Si documentano le tracce di Luminol con una fotografia a lunga esposizione. Il Luminol reagisce anche con altre sostanze: questo può portare a falsi indizi per la polizia, pertanto è necessario affiancare al test del Luminol altri tipi di test.
In particolare:
- il Luminol reagisce con il rame e la candeggina;
- il Luminol reagisce con il sangue presente nell'urina e con il sangue animale;
- il Luminol può compromettere altri tipi di test che possono portare al deperimento di prove, anche se è stato provato che il test del DNA può essere effettuato in maniera sicura anche su campioni trattati con Luminol.
Note[modifica | modifica wikitesto]
- ^ Sigma Aldrich; rev. del 26.02.2010
- ^ Luminolo, in Grande Dizionario di Italiano, Garzanti Linguistica.
- ^ Huntress et al., J. Am. Chem. Soc., 1934, 241.
- ^ Synthesis of luminol Archiviato il 25 aprile 2009 in Internet Archive.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Luminol
Wikimedia Commons contiene immagini o altri file su Luminol
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) luminol, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Sintesi del Luminol, su cas.bellarmine.edu.
- (EN) HowStuffWorks "Come funziona il Luminol", su people.howstuffworks.com.
| Controllo di autorità | GND (DE) 4336331-3 |
|---|
