Idrogeno autotrasferito
La catalisi dell'idrogeno autotrasferito, anche detta autotrasferimento d'idrogeno, idrogeno in prestito, attivazione deidrogenativa e attivazione elettronica catalitica, è un concetto catalitico importante. Tale reazione organica è un'estensione dell'idrogenazione per trasferimento (l'atomo H donore appartiene ad un reagente, non in-situ generato dal substrato), è pure un tipo di reazione domino.
Nel ciclo dell'idrogeno in prestito illustrato, si parte da un reagente chimico (substrato inerte) che viene ossidato producendo composti elettrofili (sottrazione di H2) e quindi molto reattivi (substrato reagente) facendoli reagire per dare un composto chimico attivo (substrato prodotto) che viene ridotto (addizione di H2) fornendo un composto inerte.
Tutto ciò avviene sempre su un substrato solido (catalizzatore metallico formato usualmente da complessi dei metalli di transizione del gruppo 10B, rutenio, rodio.Vedi la sezione voci correlate). Il catalizzatore deidrogena il substrato e trasferisce formalmente gli atomi di H a un intermedio insaturo, producendo reazioni che liberano H2O, ma non H2.
Reazioni[modifica | modifica wikitesto]
Ammi(n/d) azione di alcooli[modifica | modifica wikitesto]
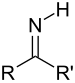
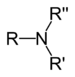
Si basa sull'ossidazione di un substrato inerte con alcol (intermedio) alla corrispondente aldeide tramite un catalizzatore (che "prende" l'idrogeno dal substrato); l'aldeide intermedia reagisce con e.g. un'ammina secondaria in una reazione di condensazione per produrre e.g. una immina, viene ridotta dal catalizzatore nel passo finale per dare e.g. un'ammina terziaria.[1][2][3]
Il metodo è ad elevata economia atomica, perché evita l'attivazione dell'alcool (scarso elettrofilo, vedi tosilazione o l'ossidazione di Swern). Possiamo riassumere con la seguente tabella:
| Alcool | Ammina secondaria | Catalizzatore | Aldeide | Immina | Ammina terziaria | ||
|---|---|---|---|---|---|---|---|

|

|
→ | 
|
|
→ | 
|
Alcooli come elettrofili per nucleofili organici[modifica | modifica wikitesto]
Il methodo non è limitato alla preparazione di ammine, ma viene usato pure per formare legami C-C.[4]
Gli alcooli vengono convertiti temporaneamente in composti carbonilici tramite la rimozione dell'idrogeno sul catalizzatore metallico (substrato). I composti carbonilici sono reattivi in una gamma più ampia di trasformazioni rispetto agli alcooli precursori e possono reagire in situ per dare immine, alcheni, e composti carbonilici α-funzionali. Il catalizzatore metallico, che aveva preso in prestito l'idrogeno, lo ritorna al composto carbonile trasformato, ottenendo un processo completo dove gli alcooli vengono convertiti in ammine, composti con legami C-C, e alcooli β-funzionali.[5]
Altre[modifica | modifica wikitesto]
Il riscaldamento a microonde consente alla strategia dell'idrogeno in prestito di formare legami C-N da alcooli e ammine, togliendo il solvente e riducendo i tempi di reazione, mentre i risultati sono paragonabili a quelli che usano il riscaldamento termico.[6]
Anche i composti nitroaromatici possono dare queste reazioni, riducendo il nitro ad ammina e immina dando ammine secondarie.[7]
Vantaggi e svantaggi[modifica | modifica wikitesto]
- Nessuna ossidazione o riduzione netta avviene nel ciclo catalitico
- Efficienza atomica elevata
- Esempio di chimica verde - sottoprodotti e sprechi molto piccoli (di solito libera solo acqua)
- Eliminazione delle fluttuazioni inutili dello stato di ossidazione
- Permette l'analisi retrosintetica alternativa
- Richiede alte temperature (110-180 °C)
- Il catalizzatore non deve interferire con i reagenti (non è un problema con i protocolli a 2 fasi)
- La selettività dell'attivazione può essere un problema
Applicazioni[modifica | modifica wikitesto]
La metodologia di autotrasferimento dell'idrogeno è stata applicata nella reazione di Knoevenagel, variante della condensazione aldolica.
Note[modifica | modifica wikitesto]
- ^ (EN) Hamid Malai Haniti S. A.; Slatford Paul A.; Williams Jonathan M. J., Borrowing Hydrogen in the Activation of Alcohols, in Adv. Synth. Catal., vol. 349, n. 10, 2007, p. 1555, DOI:10.1002/adsc.200600638.
- ^ (EN) M. Hamid (2008). Conversion of Alcohols into Amines by Borrowing Hydrogen. (Tesi Ph.D. Università di Bath)
- ^ (EN) D. Hollmann (2008). New Applications of the Borrowing Hydrogen Methodology — Selective Synthesis of Amines and Mechanistic Studies. (Tesi Dr. rer. nat.)
- ^ (EN) Pridmore Simon J.; Williams Jonathan M.J., C–C bond formation from alcohols and malonate half esters using borrowing hydrogen methodology, in Tetrahedron Lett., vol. 49, n. 52, 2008, p. 7413, DOI:10.1016/j.tetlet.2008.10.059.
- ^ (EN) Hamid, M. H. S.; Slatford, P. A.; Williams, J. M., Borrowing Hydrogen in the Activation of Alcohols, in Adv. Synth. Catal., vol. 249, 2007, pp. 1555-1575, DOI:10.1002/adsc.200600638.
- ^ (EN) A. J. A. Watson; A. C. Maxwell; J. M. J. Williams, Borrowing Hydrogen Methodology for Amine Synthesis under Solvent-Free Microwave Conditions, in J. Org. Chem., vol. 76, n. 7, 2011, pp. 2328-2331, DOI:10.1021/jo102521a.
- ^ (EN) Rubio-Marqués, Paula; Leyva-Pérez, Antonio; Corma, Avelino, A bifunctional palladium/acid solid catalyst performs the direct synthesis of cyclohexylanilines and dicyclohexylamines from nitrobenzenes, in Chem. Commun., vol. 49, n. 74, 2013, pp. 8160-8162, DOI:10.1039/C3CC44064H.
Bibliografia[modifica | modifica wikitesto]
- (EN) Williams J.M.J., Dalton Trans. 2009, pp. 753-762. (Reazioni con alcooli).
- (EN) Krische, ACIEE 2009, vol. 48, pp. 34-36. (Alcooli + alcheni/alchini)
- (EN) Gabriela Guillena, Diego J. Ramón, Miguel Yus, Hydrogen Autotransfer in the N-Alkylation of Amines and Related Compounds using Alcohols and Amines as Electrophiles, in Chem. Rev. 2010, 110 (3), ASAP, pp. 1611-1641, DOI:10.1021/cr9002159. (Reazioni classificate per catalizzatore)
- (EN) Graham E. Dobereiner, Robert H. Crabtree, Dehydrogenation as a Substrate-Activating Strategy in Homogeneous Transition-Metal Catalysis, in Chem. Rev. 2010, 110 (2), ASAP, pp. 681-703, DOI:10.1021/cr900202j. (Alcani)
- (EN) J. M. J. Williams et al, JACS 2009, vol. 131, p. 1766. (Amminazione di alcooli. Punteggi di tabelle che mostrano campi di applicazioni del miglior sistema catalizzatore ad oggi [(η6-cimene) RuCl2]2).
- (EN) C. Gunanathan, D. Milstein, Applications of Acceptorless Dehydrogenation and Related Transformations in Chemical Synthesis, in Science 2013, vol. 131, p. 341, DOI:10.1126/science.1229712.
Voci correlate[modifica | modifica wikitesto]
- (Cimene)rutenio dicloruro dimero, [(η6-cimene) RuCl2]2.
- Tris(trifenilfosfina)rutenio dicloruro, RuCl2(PPh3)3.
- dppf, Fe(C5H4PPh2)2.
- Reazione di Eschweiler-Clarke
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Idrogeno autotrasferito
Wikimedia Commons contiene immagini o altri file su Idrogeno autotrasferito


