Diagramma di Tanabe-Sugano
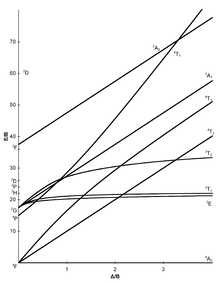
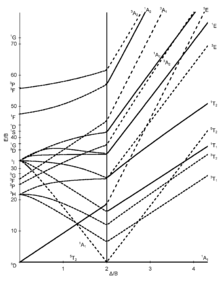
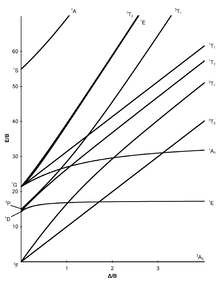
I diagrammi Tanabe-Sugano sono usati in chimica di coordinazione per prevedere gli assorbimenti nello spettro elettromagnetico UV-Vis e e IR dei composti di coordinazione. Sono qualitativamente utili al fine di spiegare l'assorbimento nelle regioni di spettro IR, e UV-Vis e possono essere utilizzati per approssimare il valore di 10Dq, l'energia del campo cristallino dei leganti. I diagrammi di Tanabe-Sugano possono essere utilizzati sia per i complessi ad alto spin che per quelli a basso spin, a differenza del Diagramma di Orgel, che si applica solo a complessi ad alto spin. Si definiscono complessi ad alto spin, o composti al alta molteplicità di spin, quei complessi metallici inorganici in cui sono presenti un alto numero di elettroni spaiati negli orbitali molecolari presenti nel complesso. Viceversa sono definiti complessi a basso spin, o composti a bassa molteplicità di spin, i complessi in cui gli elettroni sono perlopiù appaiati.
In un diagramma di Tanabe-Sugano, lo stato fondamentale viene utilizzato come riferimento costante, in contrasto con i diagrammi di Orgel. L'energia dello stato fondamentale viene considerata pari a zero per tutte le intensità di campo e le energie di tutti gli altri termini e dei loro componenti vengono tracciate rispetto allo stato fondamentale.
Parametri[modifica | modifica wikitesto]
L'ascissa di un diagramma Tanabe–Sugano è espressa in termini del rapporto tra il parametro di divisione del campo del legante, Δo oppure 10Dq e il parametro di Racah, B. Anche l'ordinata è espressa secondo il rapporto tra energia, E, e del parametro di Racah, B. in generale, esistono tre parametri di Racah, A, B e C, che descrivono vari aspetti della repulsione interelettronica. Il termine A indica la repulsione interelettronica totale media. I termini B e C corrispondono a repulsioni individuali degli elettroni negli orbitali d. A è costante nella configurazione degli elettroni negli orbitali d, quindi non è presente nei diagrammi di Tanabe e Sugano sugli ioni complessi. Infine il termine C è necessario solo in alcuni casi. Di conseguenza B è il più importante dei parametri di Racah in questo caso.[1]
Ogni linea corrisponde a uno stato elettronico diverso. La flessione di alcune linee è dovuta alla miscelazione di termini con la stessa simmetria. Nel diagramma di Tanabe-Sugano sono inoltre riportati i livelli di energia di transizioni elettroniche non permesse dalla regola di selezione di molteplicità di spin, la quale afferma che durante una transizione elettronica la molteplicità di spin non varia.[2] Dire che la molteplicità di spin rimane invariata significa che gli elettroni non cambiano il numero atomico di spin (+1/2 o -1/2) quando vengono eccitati. A ogni stato energetico viene assegnata un'etichetta di simmetria (ad es A, T1g, T2g, ecc.), tuttavia i pedici "g" e "u" sono di solito esclusi dal diagramma di Tanabe-Sugano, al fine di renderlo più leggibile. Le etichette per ogni stato sono generalmente scritte sul lato destro del diagramma, o nel caso di diagrammi più complicati (ad es. D6) le etichette possono essere scritte in altre posizioni al fine di rendere più chiara l'interpretazione. Il termine spettroscopico (ad esempio 3P, S1, etc.) per una specifica configurazione dn sono elencati, in ordine crescente di energia, in ordinata nel diagramma. L'ordine relativo delle energie è determinato usando le regole di Hund. Per un complesso ottaedrico, i termini spettroscopici di complessi metallici si dividono di conseguenza:[3]
| Termine | Degenerazione | Stati in un campo ottaedrico |
|---|---|---|
| S | 1 | A1g |
| P | 3 | T1u |
| D | 5 | Eg + T2g |
| F | 7 | A2g + T1g + T2g |
| G | 9 | A1g + Eg + T1g + T2g |
| H | 11 | Eg + T1g + T1g + T2g |
| I | 13 | A1g + A2g + Eg + T1g + T2g + T2g |
Alcuni diagrammi di Tanabe–Sugano (d4, d5, d6 e d7) presentano una linea verticale tracciata ad uno specifico valore Dq/B, che corrisponde a una discontinuità nelle pendenze dei livelli di energia degli stati eccitati. Questa discontinuità dell'andamento dell'energia riflette l'appaiamento di spin degli elettroni negli orbitali molecolari. I complessi a sinistra di questa linea (valori Dq/B più bassi) sono ad alto spin, mentre i complessi a destra (valori Dq/B più alti) sono a basso spin. Non esiste una denominazione ad alto o basso spin per configurazioni d2, d3 o d8 .[4]
Esempi di Diagrammi Tanabe-Sugano[modifica | modifica wikitesto]
Di seguito sono mostrati alcuni diagrammi di Tanabe-Sugano per i corrispondenti complessi ottaedrici.[1][5][6]
Configurazioni d1, d9 e d10[modifica | modifica wikitesto]
Configurazione d1[modifica | modifica wikitesto]
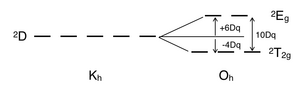
Un complesso metallico ottaedrico d1, come nel complesso [Ti(H2O)6]3+, mostra una singola banda di assorbimento nello spettro UV-Vis.[1] Il termine spettroscopico per la configurazione d1 è 2D, nella quale i cinque orbitali molecolari si scindono nei due gruppi entrambi degeneri t2g e eg di energia rispettivamente 4 Dq e 6 Dq. In prima approssimazione, quindi, tutte le transizioni tra questi due stati richiedono la stessa energia, e uno spettro UV-Vis di un composto d1 mostra un solo picco di assorbimento, non richiedendo l'uso del Diagramma di Tanabe-Sugano.
Configurazione d9[modifica | modifica wikitesto]
Similmente a d1, i complessi metallici d9 hanno termine spettroscopico 2D. La transizione si verifica dalla configurazione (t2g)6(eg)3 (stato 2Eg) alla configurazione (t2g)5(eg)4 (stato 2T2g). Ciò può anche essere descritto come un "buco" positivo che si sposta dagli orbitali eg agli orbitali t2g. Il segno di Dq è opposto a quello di d1, con uno stato fondamentale 2Eg e uno stato eccitato 2T2g. A differenza dei complessi d1, i complessi d9, mostrano un picco non totalmente simmetrico nello spettro UV-Vis, dovuta a una distorsione di Jahn-Teller, che rimuove la degenerazione dei due gruppi di orbitali prima degeneri t2g e eg. Essendo tuttavia la degenerazione dovuta ad una differenza di energia minima, i complessi ottaedrici d9 non richiedono il diagramma Tanabe–Sugano per prevedere i loro spettri di assorbimento.
Configurazioni d0 d10[modifica | modifica wikitesto]
In un metallo con configurazione d0 non sono presenti elettroni negli orbitali d, quindi non ci possono essere assorbimenti nel campo dell'UV-Vis. In una configurazione d10, non ci sono transizioni di elettroni d-d perché gli orbitali d sono completamente riempiti. Pertanto, le bande di assorbimento UV-vis non vengono osservate e non è necessario costruire un diagramma di Tanabe-Sugano.
Note[modifica | modifica wikitesto]
- ^ a b c Peter Atkins, Tina Overton e Jonathan Rourke, Shriver & Atkins Inorganic Chemistry, 4thª ed., New York, W.H. Freeman and Company, 2006, pp. 478–483, ISBN 0-7167-4878-9.
- ^ Bodie Douglas, Darl McDaniel e John Alexander, Concepts and Models of Inorganic Chemistry, 3rdª ed., New York, John Wiley & Sons, 1994, pp. 442–458, ISBN 0-471-62978-2.
- ^ F. Albert Cotton, Geoffrey Wilkinson e Paul L. Gaus, Basic Inorganic Chemistry, 3rdª ed., New York, John Wiley & Sons, 1995, pp. 530–537, ISBN 0-471-50532-3.
- ^ Daniel C. Harris e Michael D. Bertolucci, Symmetry and Spectroscopy: An Introduction to Vibrational and Electronic Spectroscopy, New York, Dover Publications, Inc., 1978, pp. 403–409, 539, ISBN 978-0-486-66144-5.
- ^ CONFCHEM, http://confchem.ccce.divched.org/sites/confchem.ccce.divched.org/files/Interpretation%20of%20the%20spectra%20of%20first-row%20transition%20metal%20complexes%20%28textbook%20problems%29.pdf.
- ^ Robert John Lancashire, Tanabe-Sugano diagrams via spreadsheets, su wwwchem.uwimona.edu.jm, 25 September 2006. URL consultato il 29 November 2009.