Bicarbonato d'ammonio
Vai alla navigazione
Vai alla ricerca
| Bicarbonato d'ammonio | |
|---|---|
 | |
| Nomi alternativi | |
| idrogenocarbonato d'ammonio | |
| Caratteristiche generali | |
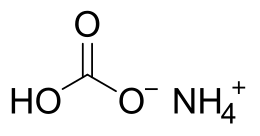
| Formula bruta o molecolare | (NH4)HCO3 |
| Massa molecolare (u) | 79,06 |
| Aspetto | solido incolore |
| Numero CAS | |
| Numero EINECS | 213-911-5 |
| PubChem | 14013 |
| DrugBank | DBDB15925 |
| SMILES | N.O=C(O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,586 g/cm³ |
| Solubilità in acqua | 220 g/L (20 °C) |
| Temperatura di fusione | 106 °C (379 K) (in capillare chiuso) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 302 |
| Consigli P | --- [1] |
Il bicarbonato d'ammonio (o idrogenocarbonato d'ammonio) è un sale acido dell'ammoniaca e dell'acido carbonico, avente formula (NH4)HCO3.
Proprietà
[modifica | modifica wikitesto]A temperatura ambiente si presenta come un solido incolore dall'odore lieve di ammoniaca. Si decompone a temperature superiori a 35 °C producendo fumi di ammoniaca. Reagisce velocemente con acidi, basi forti e forti ossidanti.
Applicazioni
[modifica | modifica wikitesto]Viene utilizzato nell'industria alimentare come agente lievitante nella preparazione di dolciumi o come regolatore di acidità (ha sigla E503) e viene usato anche negli estintori e come agente di rigonfiamento in materiali plastici porosi.
Note
[modifica | modifica wikitesto]- ^ scheda del bicarbonato d'ammonio su IFA-GESTIS
Bibliografia
[modifica | modifica wikitesto]- Dario Bressanini, La scienza della pasticceria: la chimica del bignè, Milano, Gribaudo, 2022, ISBN 978-88-580-1230-7.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su bicarbonato d'ammonio
Wikimedia Commons contiene immagini o altri file su bicarbonato d'ammonio
| Controllo di autorità | Thesaurus BNCF 36781 · LCCN (EN) sh2008000090 · J9U (EN, HE) 987007537613005171 |
|---|

