Benzino
| Benzino | |
|---|---|
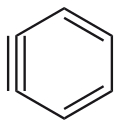 | |
 | |
| Nome IUPAC | |
| 1,3-cicloesadien-5-ino | |
| Nomi alternativi | |
| benzino 1,2-deidrobenzene arino | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C6H4 |
| Numero CAS | |
| PubChem | 123068 |
| SMILES | C1=CC#CC=C1 |
| Indicazioni di sicurezza | |
Il benzino è un composto chimico aromatico capostipite degli arini.
È l'intermedio di reazione in quelle reazioni di sostituzione nucleofila aromatica che procedono per eliminazione-addizione e vengono quindi dette reazioni via benzino. Si tratta quindi di una molecola vera e propria (non di uno stato di transizione) che però è particolarmente difficile da isolare.
Prende parte anche a reazioni tipo Diels-Alder essendo un dienofilo.
Scoperta[modifica | modifica wikitesto]
L'esistenza del benzino fu postulata da Georg Wittig nel 1940[1][2][3] e confermata sperimentalmente da John D. Roberts nel 1953.[4][5][6][7][8]
La scoperta del benzino portò ad un rapido sviluppo delle metodologie di sintesi per sfruttare questo intermedio altamente reattivo nelle sintesi organiche. Da allora è stata preparata una grande varietà di prodotti usando gli arini come intermedi.[9]
Ulteriori evidenze dell'esistenza del benzino vennero da studi spettroscopici IR,[10] UV/Vis,[11] microonde,[12] e NMR.[13][14]
Caratteristiche[modifica | modifica wikitesto]
La molecola, rispetto al benzene, contiene un legame π in più ma è pur sempre aromatica; la reattività è molto spiccata in quanto gli orbitali che formano il triplo legame sono poco sovrapposti a causa della geometria della molecola. Anche le evidenze spettroscopiche mostrano un legame dalle caratteristiche intermedie tra un doppio e un triplo legame: la frequenza di stiramento del legame nella spettroscopia infrarossa e lo spostamento chimico nello spettro 13C-NMR difatti sono anomali.
Esistono anche isomeri diradicalici che sono stati determinati via EPR:

Può essere preparato per reazione di un alogenuro arilico con ammoniuro:

Oppure a partire dall'acido antranilico: ne viene preparato il corrispondente diazocomposto, poi con argento viene rimosso il controione con formazione del sale interno (benzendiazonio-2-carbossilato) che per riscaldamento elimina azoto e anidride carbonica con formazione di benzino:

Note[modifica | modifica wikitesto]
- ^ Wittig, G., Pieper, G. and Fuhrmann, G. (1940), Über die Bildung von Diphenyl aus Fluorbenzol und Phenyl-lithium (IV. Mitteil. über Austauschreaktionen mit Phenyl-lithium). Berichte der deutschen chemischen Gesellschaft (A and B Series), 73: 1193–1197. DOI: 10.1002/cber.19400731113
- ^ Georg Wittig, Phenyl-lithium, der Schlüssel zu einer neuen Chemie metallorganischer Verbindungen, Naturwissenschaften, 1942, Volume 30, Numbers 46-47, Pages 696-703 DOI: 10.1007/BF01489519
- ^ Wittig, G. (1954), Fortschritte auf dem Gebiet der organischen Aniono-Chemie. Angewandte Chemie, 66: 10–17. DOI: 10.1002/ange.19540660103
- ^ John D. Roberts, Howard E. Simmons Jr., L. A. Carlsmith, C. Wheaton Vaughan, Rearrangement in the reaction of chlorobenzene-1-C14 with potassium amid, J. Am. Chem. Soc., 1953, 75 (13), pp 3290–3291 DOI: 10.1021/ja01109a523
- ^ John D. Roberts, Dorothy A. Semenow, Howard E. Simmons Jr., L. A. Carlsmith, The Mechanism of Aminations of Halobenzenes, J. Am. Chem. Soc., 1956, 78 (3), pp 601–611 DOI: 10.1021/ja01584a024
- ^ John D. Roberts, C. Wheaton Vaughan, L. A. Carlsmith, Dorothy A. Semenow, Orientation in Aminations of Substituted Halobenzenes, J. Am. Chem. Soc., 1956, 78 (3), pp 611–614 DOI: 10.1021/ja01584a025
- ^ Lutz Ackermann (ed.), Modern Arylation Methods, 2009, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim ISBN 978-3-527-31937-4
- ^ H. Heaney, The Benzyne and Related Intermediates, Chem. Rev., 1962, 62 (2), pp 81–97 DOI: 10.1021/cr60216a001
- ^ Tadross, P. M.; Stoltz, B. M., A Comprehensive History of Arynes, in Natural Product Total Synthesis, Chem. Rev., 2012, 112, 3550
- ^ Radziszewski, J. G.; Hess, Jr. B. A.; Zahradnik, R. J. Am. Chem. Soc. 1992, 114, 52.
- ^ Wenthold, P. G.; Squires, R. R.; Lineberger, W. C. J. Am. Chem. Soc. 1998, 120, 5279
- ^ Kukolich, S. G.; Tanjaroon,C.; McCarthy, M. C.; Thaddeus, P. J. Chem. Phys. 2003, 119, 4353
- ^ Orendt, A. M.; Facelli, J. C.; Radziszewski, J. G.; Horton, W. J.; Grant, D. M.; Michl, J. J. Am. Chem. Soc. 1996, 118, 846
- ^ Warmuth,R., Angew. Chem., Int. Ed. Engl., 1997, 36, 1347
Bibliografia[modifica | modifica wikitesto]
- S.N. Eğe, Chimica Organica, Edizioni Sorbona.
- K.P.C. Vollhardt, N.E. Schore, Chimica Organica, Zanichelli, ISBN 88-08-07521-4.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Benzino
Wikimedia Commons contiene immagini o altri file su Benzino
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) benzyne, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.