1,2-bis(difenilfosfino)etano
| 1,2-bis(difenilfosfino)etano | |
|---|---|
 | |
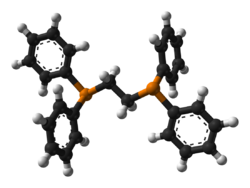 | |
| Nomi alternativi | |
| dppe, diphos | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C26H24P2 |
| Massa molecolare (u) | 398,42 |
| Aspetto | polvere cristallina bianca |
| Numero CAS | |
| Numero EINECS | 216-769-2 |
| PubChem | 74267 |
| SMILES | C1=CC=C(C=C1)P(CCP(C2=CC=CC=C2)C3=CC=CC=C3)C4=CC=CC=C4 |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 138-143 °C (411-416 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi R | 36/37/38 |
| Frasi S | 26, 37 |
Il 1,2-bis(difenilfosfino)etano è una fosfina con formula Ph2P-CH2-CH2-PPh2 (Ph = fenile). Il nome è generalmente abbreviato come dppe o anche diphos. In condizioni normali è un solido cristallino di colore bianco sensibile all'ossigeno atmosferico. Viene comunemente usato come legante bidentato. Il dppe funziona nella maggior parte dei casi come legante chelato, ma può fungere anche da legante a ponte tra due metalli.[1]
Sintesi[modifica | modifica wikitesto]
Per preparare il dppe si parte da trifenilfosfina (PPh3) e sodio, che formano difenilfosfuro di sodio (NaPPh2); quest'ultimo viene quindi trattato con 1,2-dicloroetano (ClCH2CH2Cl) per ottenere dppe:[2][3]
- PPh3 + 2Na → NaPPh2 + NaPh
- 2NaPPh2 + ClCH2CH2Cl → Ph2PCH2CH2PPh2 + 2NaCl
Reattività[modifica | modifica wikitesto]
Riduzione[modifica | modifica wikitesto]
È noto che la riduzione del dppe con litio porta dapprima al diradicale anionico stabilizzato dal litio; per successiva idrolisi si arriva al prodotto finale di riduzione, PhHP(CH2)2PHPh:[4]
- Ph2P(CH2)2PPh2 + 4Li → PhLiP(CH2)2PLiPh + 2PhLi
- PhLiP(CH2)2PLiPh + 2PhLi + 4H2O → PhHP(CH2)2PHPh + 4LiOH + 2C6H6
Ossidazione[modifica | modifica wikitesto]
La reazione del dppe con ossidanti convenzionali come perossido di idrogeno (H2O2) o bromo in soluzione acquosa (Br2) procede in modo non selettivo e porta a miscele contenenti il prodotto di partenza, il monossido e il diossido.[5] L'ossidazione selettiva al mono fosfinossido si può ottenere per reazione con PhCH2Br e successiva idrolisi catalizzata da basi:
- Ph2P(CH2)2PPh2 + PhCH2Br → Ph2P(CH2)2PPh2(CH2Ph)+Br-
- Ph2P(CH2)2PPh2(CH2Ph)+Br- + NaOH + H2O → Ph2P(CH2)2P(O)Ph2
Come legante[modifica | modifica wikitesto]
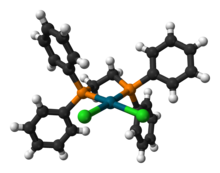
Il dppe è molto usato come legante, soprattutto in complessi da utilizzare in catalisi omogenea per reazioni di vario tipo. Due complessi semplici sono Pd(dppe)2 e Ir(dppe)2. Pd(dppe)2 si può preparare riducendo il Pd(II) con boroidruro di sodio NaBH4, ma è più comodo ottenerlo in situ da Pd(OAc)2.[5]
Indicazioni di sicurezza[modifica | modifica wikitesto]
Il composto è disponibile in commercio. È irritante per gli occhi, la pelle e le vie respiratorie. Non ci sono dati che indichino proprietà cancerogene. Non è considerato pericoloso per l'ambiente.[6]
Note[modifica | modifica wikitesto]
- ^ Cotton et al. 1999.
- ^ Hewertson e Watson 1962.
- ^ Girolami et al. 1999.
- ^ Dogan et al. 2000.
- ^ a b Paquette 2001.
- ^ Alfa Aesar, Scheda di dati di sicurezza del dppe (PDF), su alfa.com. URL consultato il 15 novembre 2011.
Bibliografia[modifica | modifica wikitesto]
- F. A. Cotton, G. Wilkinson, C. A. Murillo e M. Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley, 1999, ISBN 978-0-471-19957-1.
- J. Dogan, J. B. Schulte, G. F. Swiegers e S. B. Wild, Mechanism of Phosphorus-Carbon Bond Cleavage by Lithium in Tertiary Phosphines. An Optimized Synthesis of 1, 2-Bis (phenylphosphino) ethane, in J. Org. Chem., vol. 65, n. 4, 2000, pp. 951–957, DOI:10.1021/jo9907336. URL consultato il 14 novembre 2011.
- G. Girolami, T. Rauchfuss e R. Angelici, Synthesis and Technique in Inorganic Chemistry, 3ª ed., Sausalito, CA, University Science Books, 1999, ISBN 0-935702-48-2.
- W. Hewertson e H. R. Watson, 283. The preparation of di- and tri-tertiary phosphines, in J. Chem. Soc., 1962, pp. 1490–1494, DOI:10.1039/JR9620001490. URL consultato il 14 novembre 2011.
- L. A. Paquette (a cura di), Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2001, ISBN 978-0-470-84289-8.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su 1,2-bis(difenilfosfino)etano
Wikimedia Commons contiene immagini o altri file su 1,2-bis(difenilfosfino)etano