Stem-loop
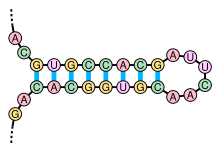
Lo stem-loop è una conformazione intramolecolare basata sull'accoppiamento delle basi azotate che può insorgere a livello di un DNA a singolo filamento o, più frequentemente, in RNA. Questa struttura è anche nota come forcina o ansa forcina.
Essa insorge quando due regioni dello stesso filamento si accoppiano in accordo con le regole di appaiamento delle basi azotate formando una doppia elica che termina in un'ansa non appaiata. Generalmente le regioni che manifestano questa struttura sono provvisti di una sequenza complementare se lette in direzioni opposte. Lo stem-loop è una struttura che sta alla base di molte conformazioni secondarie dell'RNA ed ha molte funzioni di fondamentale utilità, come ad esempio può influenzare il ripiegamento strutturale del filamento, ha funzione protettiva per l'RNA messagero (mRNA), può fornire l'RNA di siti di riconoscimento per proteine specifiche (RNA binding proteins) e funge da substrato per reazioni enzimatiche.[1]
Formazione e stabilità[modifica | modifica wikitesto]
La nascita di una struttura stem-loop dipende dalla stabilità della doppia elica e dell'ansa che si formano. Il primo prerequisito è la presenza di una sequenza che può ripiegarsi su sé stessa per appaiarsi con la sequenza complementare. La stabilità dell'elica è determinata dalla sua lunghezza, dal numero di mismatch che contiene (in eliche molto lunghe è possibile tollerarne la presenza senza causare eccessiva instabilità) e dalla composizione in basi della regione appaiata. Appaiamenti tra guanina e citosina hanno tre legami ad idrogeno e sono, per questo, più stabili rispetto alla coppia adenina-uracile, che ne possiede solo due. Nell'RNA la coppia adenina-uracile- ha caratteristiche paragonabili, dunque simili, alla coppia adenina-timina nel DNA.
A promuovere in ultimo la formazione dell'elica sono le interazioni di impilamento delle basi (base stacking), dove si genera un allineamento degli orbitali π degli anelli aromatici delle basi azotate.
La stabilità dell'ansa è anche importante per la formazione della struttura stem-loop. Anse lunghe meno di tre basi non possono generarsi a causa dell'ingombro sterico che si genera. Anse molto grandi prive di una propria struttura secondaria che le stabilizzi (ad esempio pseudonodi) sono anche instabili. La lunghezza ottimale si aggira intorno a 4-8 basi. Esiste una diffusa sequenza dell'ansa, UUCG, nota in letteratura come tetraloop, dotata di particolare stabilità a causa di interazioni di impilamento delle basi nucleotidiche
Contesto strutturale[modifica | modifica wikitesto]
Spesso gli stem-loops si manifestano in precursori dei microRNA, mentre sono estremamente note nei transfer RNA, dove sono presenti tre stem-loops reali ed uno stelo che incontra una struttura a quadrifoglio. L'anticodone che riconosce il proprio codone durante il processo di traduzione è localizzato su una delle anse non appaiate all'interno del tRNA. Negli pseudonodi sono presenti due stem-loops, dove l'ansa di uno forma il secondo stelo.
Molti ribozimi sono dotati di strutture stem-loop. Il ribozima a testa di martello contiene tre stem-loops che si incontrano in una regione centrale non appaiata che funge da sito di clivaggio; questa struttura secondaria è indispensabile per il funzionamento di questo enzima.
Nei procarioti ritroviamo anse a forcina all'interno della regione 5'UTR. Queste strutture sono spesso legate da proteine o sono fonte di un'attenuazione dell'efficienza di traduzione, per cui hanno un'attività regolatoria.[2]
Lo stem-loop presente a livello della sequenza di Shine-Dalgarno funge da controllo dell'inizio della traduzione.[3][4]
È anche importante citare l'utilità di questa struttura all'interno della terminazione rho-indipendente della trascrizione all'interno dei procarioti. La struttura stem-loop va a formarsi sulla sequenza di mRNA in fase di trascrizione e causa la dissociazione della RNA polimerasi dal filamento stampo. Questo processo prende il nome di terminazione rho-indipendente o terminazione intrinseca e la sequenza coinvolta prende il nome di terminatore.
Note[modifica | modifica wikitesto]
- ^ Svoboda, P., & Cara, A. (2006). Hairpin RNA: A secondary structure of primary importance. Cellular and Molecular Life Sciences CMLS, 63(7), 901-908.
- ^ Michelle Meyer, Deiorio-Haggar K e Anthony J, RNA structures regulating ribosomal protein biosynthesis in bacilli, in RNA BIology, 7, vol. 10, July 2013, pp. 1160–1164, DOI:10.4161/rna.24151, PMC 3849166, PMID 23611891.
- ^ Malys N, Nivinskas R, Non-canonical RNA arrangement in T4-even phages: accommodated ribosome binding site at the gene 26-25 intercistronic junction, in Mol Microbiol, vol. 73, n. 6, 2009, pp. 1115–1127, DOI:10.1111/j.1365-2958.2009.06840.x, PMID 19708923.
- ^ Malys N, McCarthy JEG, Translation initiation: variations in the mechanism can be anticipated, in Cellular and Molecular Life Sciences, vol. 68, n. 6, 2010, pp. 991–1003, DOI:10.1007/s00018-010-0588-z, PMID 21076851.