MoaA
| MoaA | |
|---|---|
 Modello tridimensionale dell'enzima | |
| Numero EC | 4.1.99.18 |
| Classe | Liasi |
| Banche dati | BRENDA, EXPASY, GTD, PDB (RCSB PDB PDBe PDBj PDBsum) |
| Fonte: IUBMB | |
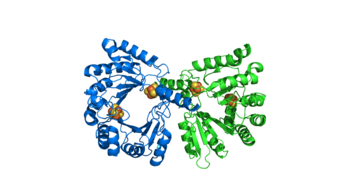
MoaA appartiene alla superfamiglia degli enzimi metilasi dipendenti dal coenzima S-adenosil metionina (SAM), le quali con centri ferro-zolfo [4Fe-4S]2+ formano un radicale mediante la divisione riduttiva del SAM. Caratteristica delle proteine MoaA è di contenere addirittura due centri ferro-zolfo. La struttura cristallina rivela che essa ha forma di un omodimero allungato con dimensioni di 79 Å × 58 Å × 45 Å. Il nucleo centrale di ciascun monomero, formato dalla parte N-terminale della proteina, è composto da una incompleta struttura [(αβ)6] a barile TIM con una apertura laterale. Il C-terminale della proteina copre l'apertura laterale del cilindro . Questa parte è composta da tre filamenti antiparalleli disposti a foglietto β e tre α-eliche. È interessante notare che un canale idrofilo è presente al centro della barile TIM. [1]
Nella biosintesi batterica del cofattore molibdeno la proteina MoaA è coinvolta insieme alla proteine MoaC nella trasformazione del GTP in precursore Z.
La analoga proteina umana di MoaA è conosciuta come MOCS1A [2].
Note[modifica | modifica wikitesto]
- ^ Petra Hänzelmann, Hermann Schindelin, Binding of 5'-GTP to the C-terminal FeS cluster of the radical S-adenosylmethionine enzyme MoaA provides insights into its mechanism., in Proc.Natl.Acad.Sci.USA, n. 103, 2006, pp. 6829-6834, DOI:10.1073/pnas.0510711103.
- ^ Petra Hänzelmann, Heather L Hernández, Christian Menzel, Ricardo García-Serres, Boi Hanh Huynh, Michael K Johnson, Ralf R Mendel, Hermann Schindelin, Characterization of MOCS1A, an oxygen-sensitive iron-sulfur protein involved in human molybdenum cofactor biosynthesis, in The Journal of biological chemistry, vol. 279, n. 33, 13 agosto 2004, pp. 34721-34732, DOI:10.1074/jbc.M313398200, ISSN 0021-9258.