RNA ribosomale 16S: differenze tra le versioni
Creata dalla traduzione della pagina "16S ribosomal RNA" |
(Nessuna differenza)
|
Versione delle 15:07, 27 ott 2020

L'RNA ribosomiale 16 S (o rRNA 16 S ) è una componente della subunità 30S di un ribosoma procariotico che si lega alla sequenza di Shine-Dalgarno . I geni che lo codificano sono indicati come gene 16S rRNA e sono utilizzati nella ricostruzione delle filogenesi, a causa della dell'evoluzione lenta di questa regione del gene. Carl Woese e George E. Fox sono state i due ricecatori che hanno aperto la strada all'uso dell'rRNA 16S per la ricerca filogenetica a partiree dal 1977.[2]
- Come il grande RNA ribosomiale (23S), ha un ruolo strutturale, agendo come uno scaffold che definisce le posizioni delle proteine ribosomiali .
- L' estremità 3 ' contiene l'anti- sequenza Shine-Dalgarno, che si lega a monte AUG codone di inizio sul mRNA . L'estremità 3′ dell'RNA 16S si lega alle proteine S1 e S21 note per essere coinvolte nell'inizio della sintesi proteica [3]
- Interagisce con 23S, favorendo il legame delle due subunità ribosomiali ( 50S e 30S )
- Stabilizza il corretto accoppiamento codone-anticodone nel sito A, tramite una formazione di legami idrogeno tra l'atomo N1 dei residui di adenina 1492 e 1493 e il gruppo 2′OH della spina dorsale dell'mRNA
Struttura
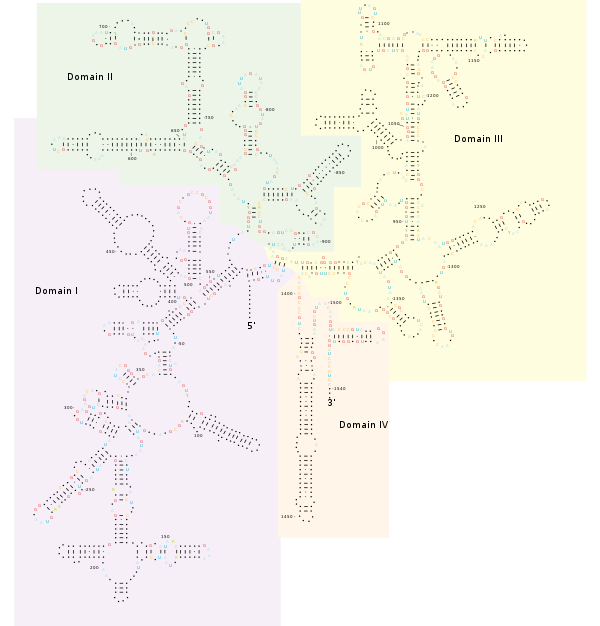
Applicazioni PCR e NGS
Oltre ai siti di legame dei primer altamente conservati, le sequenze del gene rRNA 16S contengono regioni ipervariabili che possono fornire sequenze di firma specifiche per specie utili per l'identificazione dei batteri.[4][5] Di conseguenza, il sequenziamento del gene 16S rRNA è diventato prevalente in microbiologia medica come alternativa rapida ed economica ai metodi fenotipici di identificazione batterica.[6] Sebbene fosse originariamente utilizzato per identificare i batteri, il sequenziamento 16S è stato successivamente trovato in grado di riclassificare i batteri in specie completamente nuove, [7] o anche in generi .[8] [9] È stato anche usato per descrivere nuove specie che non sono mai state coltivate con successo. [10] [11] Con il sequenziamento di terza generazione in arrivo in molti laboratori, l'identificazione simultanea di migliaia di sequenze di rRNA 16S è possibile in poche ore, consentendo studi metagenomici, ad esempio sulla flora intestinale. [12]
l gene 16S batterico contiene nove regioni ipervariabili (V1-V9), lunghe da circa 30 a 100 paia di basi, che sono coinvolte nella struttura secondaria della piccola subunità ribosomiale . [13] Il grado di conservazione varia ampiamente tra le regioni ipervariabili, con regioni più conservate correlate a tassonomia di livello superiore e regioni meno conservate a livelli inferiori, come genere e specie. [14] Sebbene l'intera sequenza 16S consenta il confronto di tutte le regioni ipervariabili, a una lunghezza di circa 1.500 coppie di basi può essere proibitivo per studi che cercano di identificare o caratterizzare diverse comunità batteriche. Questi studi utilizzano comunemente la piattaforma Illumina, che produce letture a velocità 50 volte e 12.000 volte meno costose rispetto al pirosequenziamento 454 e al sequenziamento di Sanger, rispettivamente. [15] Sebbene sia più economico e consentendo una copertura più approfondita della comunità, il sequenziamento Illumina produce letture lunghe solo 75-250 paia di basi (fino a 300 paia di basi con Illumina MiSeq) e non ha un protocollo stabilito per assemblare in modo affidabile il gene completo nei campioni della comunità. [16] Tuttavia, le regioni ipervariabili complete possono essere assemblate da una singola corsa Illumina, rendendole obiettivi ideali per la piattaforma.
Note
- ^ Structure of functionally activated small ribosomal subunit at 3.3 angstroms resolution, in Cell, vol. 102, n. 5, September 2000, pp. 615–23, DOI:10.1016/S0092-8674(00)00084-2, PMID 11007480.
- ^ Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya, in Proceedings of the National Academy of Sciences of the United States of America, vol. 87, n. 12, June 1990, pp. 4576–9, Bibcode:1990PNAS...87.4576W, DOI:10.1073/pnas.87.12.4576, PMID 2112744.
- ^ A. P. Czernilofsky, C. G. Kurland e G. Stöffler, 30S Ribosomal proteins associated with the 3′-terminus of 16S RNA, in FEBS Letters, vol. 58, n. 1, 1975, pp. 281–284, DOI:10.1016/0014-5793(75)80279-1, ISSN 0014-5793, PMID 1225593.
- ^ Identification of species by multiplex analysis of variable-length sequences, in Nucleic Acids Research, vol. 38, n. 22, December 2010, pp. e203, DOI:10.1093/nar/gkq865, PMID 20923781.
- ^ Ribosomal DNA sequencing as a tool for identification of bacterial pathogens, in Current Opinion in Microbiology, vol. 2, n. 3, June 1999, pp. 299–305, DOI:10.1016/S1369-5274(99)80052-6, PMID 10383862.
- ^ Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases, in Clinical Microbiology Reviews, vol. 17, n. 4, October 2004, pp. 840–62, table of contents, DOI:10.1128/CMR.17.4.840-862.2004, PMID 15489351.
- ^ Reverse transcription of 16S rRNA to monitor ribosome-synthesizing bacterial populations in the environment, in Applied and Environmental Microbiology, vol. 75, n. 13, July 2009, pp. 4589–98, DOI:10.1128/AEM.02970-08, PMID 19395563.
- ^ 16S ribosomal DNA amplification for phylogenetic study, in Journal of Bacteriology, vol. 173, n. 2, January 1991, pp. 697–703, DOI:10.1128/jb.173.2.697-703.1991, PMID 1987160.
- ^ Burkholderia thailandensis sp. nov., a Burkholderia pseudomallei-like species, in International Journal of Systematic Bacteriology, 48 Pt 1, n. 1, January 1998, pp. 317–20, DOI:10.1099/00207713-48-1-317, PMID 9542103.
- ^ Phylogenetic identification of uncultured pathogens using ribosomal RNA sequences, collana Methods in Enzymology, vol. 235, 1994, pp. 205–222, DOI:10.1016/0076-6879(94)35142-2, ISBN 978-0-12-182136-4.
- ^ Phylogenetic analysis of the bacterial communities in marine sediments, in Applied and Environmental Microbiology, vol. 62, n. 11, November 1996, pp. 4049–59, PMID 8899989.
- ^ Next-generation sequencing of 16S ribosomal RNA gene amplicons, in Journal of Visualized Experiments, n. 90, August 2014, DOI:10.3791/51709, PMID 25226019.
- ^ On the evolutionary descent of organisms and organelles: a global phylogeny based on a highly conserved structural core in small subunit ribosomal RNA, in Nucleic Acids Research, vol. 12, n. 14, July 1984, pp. 5837–52, DOI:10.1093/nar/12.14.5837, PMID 6462918.
- ^ Sensitivity and correlation of hypervariable regions in 16S rRNA genes in phylogenetic analysis, in BMC Bioinformatics, vol. 17, n. 1, March 2016, pp. 135, DOI:10.1186/s12859-016-0992-y, PMID 27000765.
- ^ Generation of multimillion-sequence 16S rRNA gene libraries from complex microbial communities by assembling paired-end illumina reads, in Applied and Environmental Microbiology, vol. 77, n. 11, June 2011, pp. 3846–52, DOI:10.1128/AEM.02772-10, PMID 21460107.
- ^ A method for high precision sequencing of near full-length 16S rRNA genes on an Illumina MiSeq, in PeerJ, vol. 4, 20 settembre 2016, pp. e2492, DOI:10.7717/peerj.2492, PMID 27688981.