Metabolismo del ferro: differenze tra le versioni
Creata dalla traduzione della pagina "Human iron metabolism" |
(Nessuna differenza)
|
Versione delle 11:02, 9 ott 2018
Il metabolismo del ferro umano è l'insieme delle reazioni chimiche che mantengono l'omeostasi umana del ferro a livello sistemico e cellulare. Il ferro è sia necessario per il corpo che potenzialmente tossico, e il controllo dei livelli di ferro nel corpo è una parte di importanza critica di molti aspetti della salute e delle malattie umane. Gli ematologi sono stati particolarmente interessati al metabolismo sistemico del ferro perché il ferro è essenziale per i globuli rossi, dove è contenuta la maggior parte del ferro del corpo umano. Comprendere il metabolismo del ferro è anche importante per capire le malattie del sovraccarico di ferro, come l'emocromatosi ereditaria e la carenza di ferro, come l'anemia da carenza di ferro.
Funzioni del Ferro nell' organismo umano
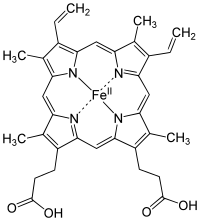
Il ferro è un bioelemento essenziale per la maggior parte delle forme di vita, dai batteri ai mammiferi. La sua importanza risiede nella sua capacità di mediare il trasferimento di elettroni. Nello stato ferroso, il ferro agisce come un donatore di elettroni, mentre nello stato ferrico agisce come un accettore. Pertanto, il ferro svolge un ruolo fondamentale nella catalisi delle reazioni enzimatiche che implicano il trasferimento di elettroni (riduzione e ossidazione, redox). Le proteine possono contenere ferro come parte di diversi cofattori, come i gruppi ferro-zolfo (Fe-S) ed i gruppi eme, che sono entrambi assemblati nei mitocondri.
Respirazione cellulare
Le cellule umane richiedono ferro per ottenere energia come ATP da un processo a più fasi noto come respirazione cellulare, più specificamente dalla fosforilazione ossidativa delle creste mitocondriali. Il ferro è presente nei gruppi ferro-zolfo ed eme delle proteine della catena di trasporto degli elettroni che generano un gradiente protonico che consente all'ATP sintasi di sintetizzare l'ATP (chemiosmosi).
I gruppi di eme sono parte dell'emoglobina, una proteina presente nei globuli rossi che serve a trasportare l'ossigeno dai polmoni ai tessuti. I gruppi di eme sono anche presenti nella mioglobina per immagazzinare e diffondere ossigeno nelle cellule muscolari.
Trasporto Ossigeno
Il corpo umano ha bisogno di ferro per il trasporto di ossigeno. L'ossigeno (O2) è richiesto per il funzionamento e la sopravvivenza di quasi tutti i tipi di cellule. L'ossigeno viene trasportato dai polmoni al resto del corpo legato al gruppo eme dell'emoglobina negli eritrociti. Nelle cellule muscolari, il ferro lega la mioglobina, che regola il suo rilascio.
Tossicità
Il ferro è anche potenzialmente tossico. La sua capacità di donare e accettare elettroni significa che può catalizzare la conversione del perossido di idrogeno in radicali liberi. I radicali liberi possono causare danni a un'ampia varietà di strutture cellulari e infine uccidere la cellula.[1]
Il ferro legato a proteine o cofattori come l'eme è sicuro. Inoltre, non ci sono virtualmente ioni di ferro veramente liberi nella cellula, poiché formano prontamente complessi con molecole organiche. Tuttavia, parte del ferro intracellulare è legato a complessi a bassa affinità e viene definito ferro labile o ferro "libero". Il ferro in tali complessi può causare danni come descritto sopra.[2]
Per prevenire questo tipo di danno, tutte le forme di vita che usano il ferro legano gli atomi di ferro alle proteine. Questo legame consente alle cellule di trarre beneficio dal ferro e allo stesso tempo limitare la sua capacità di fare del male.[3] Le concentrazioni di ferro labili intracellulari tipiche nei batteri sono 10-20 micromolari,[4] sebbene possano essere 10 volte più alti nell'ambiente anaerobico,[5] dove i radicali liberi e le specie reattive dell'ossigeno sono più scarsi. Nelle cellule di mammifero, le concentrazioni di ferro labili intracellulari sono in genere inferiori a 1 micromolare, meno del 5% del ferro totale cellulare.
Protezione dai batteri

In risposta a un'infezione batterica sistemica, il sistema immunitario avvia un processo noto come ritenuta di ferro. Se i batteri sopravvivono, devono ottenere il ferro dal loro ambiente. I batteri che causano malattie lo fanno in molti modi, tra cui rilasciando molecole che legano il ferro chiamate siderofori e quindi riassorbendoli per recuperare il ferro, o scavando il ferro dall'emoglobina e dalla transferrina. Più è difficile lavorare per ottenere il ferro, maggiore è il prezzo metabolico che devono pagare. Ciò significa che i batteri privi di ferro si riproducono più lentamente. Quindi il nostro controllo dei livelli di ferro sembra essere una difesa importante contro la maggior parte delle infezioni batteriche; Ci sono alcune eccezioni, comunque. La TB che causa il batterio può risiedere all'interno dei macrofagi che sono un ambiente ricco di ferro e Borrelia burgdorferi utilizza manganese al posto del ferro. Le persone con una maggiore quantità di ferro, come le persone con emocromatosi, sono più suscettibili ad alcune infezioni batteriche.[6]
Sebbene questo meccanismo sia una risposta elegante alle infezioni batteriche a breve termine, può causare problemi quando l'infiammazione si protrae più a lungo. Poiché il fegato produce epcidina in risposta a citochine infiammatorie, i livelli di epcidina possono aumentare come risultato di fonti non infiammatorie di infiammazione, come infezioni virali, cancro, malattie autoimmuni o altre malattie croniche. Quando ciò accade, il sequestro del ferro sembra essere la causa principale della sindrome da anemia della malattia cronica, in cui non è disponibile abbastanza ferro per produrre abbastanza globuli rossi contenenti emoglobina.
Depositi di Ferro
Le persone più ben nutrite nei paesi industrializzati hanno da 4 a 5 grammi di ferro nei loro corpi (~38 mg di ferro / kg di peso corporeo per le donne e ~50 mg di ferro / kg di corpo per gli uomini). Di questo, circa 2,5 è contenuto nell'emoglobina necessaria per trasportare l'ossigeno attraverso il sangue, e la maggior parte del resto (circa 2 grammi negli uomini adulti e un po 'meno nelle donne in età fertile) è contenuta nei complessi di ferritina che sono presenti in tutte le cellule, ma più comune nel midollo osseo, nel fegato e nella milza. Le riserve di ferritina del fegato sono la principale fonte fisiologica di ferro di riserva nel corpo. Le riserve di ferro nei paesi industrializzati tendono ad essere inferiori nei bambini e nelle donne in età fertile che negli uomini e negli anziani. Le donne che devono usare le loro riserve per compensare il ferro perso durante le mestruazioni, la gravidanza o l'allattamento hanno depositi corporei non emoglobinici inferiori, che possono essere di 500 o anche meno.
Del contenuto di ferro totale del corpo, circa 400 è dedicato alle proteine cellulari che usano il ferro per importanti processi cellulari come la memorizzazione di ossigeno (mioglobina) o l'esecuzione di reazioni redox produttrici di energia (citocromi). Una quantità relativamente piccola (3-4 mg) circola attraverso il plasma, legata alla transferrina.[7]A causa della sua tossicità, il ferro solubile libero viene mantenuto a bassa concentrazione nel corpo.
La carenza di ferro colpisce prima il ferro di deposito nel corpo e l'esaurimento di questi depositi è considerato relativamente non sintomatico, sebbene alcuni sintomi vaghi e non specifici siano stati associati ad esso. Poiché il ferro è principalmente richiesto per l'emoglobina, l'anemia da carenza di ferro è la principale manifestazione clinica della carenza di ferro. Le persone con carenza di ferro soffriranno o muoiono per danni agli organi ben prima che le cellule finiscano il ferro necessario per i processi intracellulari come il trasporto di elettroni.
I macrofagi del sistema reticoloendoteliale immagazzinano il ferro come parte del processo di scomposizione ed elaborazione dell'emoglobina dai globuli rossi inglobati. Il ferro è anche immagazzinato come un pigmento chiamato emosiderina che è un deposito mal definito di proteine e ferro, creato dai macrofagi in cui è presente eccesso di ferro, localmente o sistemicamente per esempio tra le persone con sovraccarico di ferro a causa della frequente distruzione e trasfusione di cellule del sangue. Se il sovraccarico sistemico di ferro viene corretto, nel tempo l'emosiderina viene lentamente riassorbita dai macrofagi.
Regolazione
L'omeostasi del ferro umano è regolata su due diversi livelli. I livelli sistemici di ferro sono bilanciati dall'assorbimento controllato del ferro alimentare da parte degli enterociti, dalle cellule che rivestono l'interno dell'intestino e dalla perdita incontrollata di ferro da epitassiale, sudore, ferite e perdita di sangue. Inoltre, il ferro sistemico viene continuamente riciclato. I livelli di ferro cellulare sono controllati in modo diverso da diversi tipi di cellule a causa dell'espressione di particolari proteine regolatrici e di trasporto del ferro.
Regolazione sistemica del ferro
Assorbimento del ferro alimentare
L'assorbimento del ferro alimentare è un processo variabile e dinamico. La quantità di ferro assorbita rispetto alla quantità ingerita è in genere bassa, ma può variare dal 5% fino al 35% a seconda delle circostanze e del tipo di ferro. L'efficienza con cui il ferro viene assorbito varia a seconda della fonte. Generalmente le forme di ferro meglio assorbite provengono da prodotti animali. L'assorbimento del ferro alimentare in forma di sali di ferro (come nella maggior parte dei supplementi) varia leggermente a seconda del fabbisogno di ferro del corpo e di solito è compreso tra il 10% e il 20% dell'apporto di ferro. L'assorbimento del ferro da prodotti animali e alcuni prodotti vegetali è sotto forma di ferro eme ed è più efficiente, consentendo un assorbimento dal 15% al 35% dell'assunzione. Il ferro eme negli animali proviene dal sangue e dalle proteine che contengono eme nella carne e nei mitocondri, mentre nelle piante il ferro eme è presente nei mitocondri in tutte le cellule che usano l'ossigeno per la respirazione.
Come la maggior parte dei nutrienti minerali, la maggior parte del ferro assorbito dal cibo digerito o dagli integratori viene assorbito nel duodeno dagli enterociti del rivestimento duodenale. Queste cellule hanno molecole speciali che permettono loro di spostare il ferro nel corpo. Per essere assorbito, il ferro alimentare può essere assorbito come parte di una proteina come la proteina eme o il ferro deve essere nella sua forma ferrosa di Fe2 +. Un enzima ferrico reduttasi sul bordo del pennello degli enterociti, il citocromo duodenale B (Dcytb), riduce Fe3 ferrico in Fe2 +.[8] Una proteina chiamata trasportatore di metallo divalente 1 (DMT1), che può trasportare diversi metalli bivalenti attraverso la membrana plasmatica, quindi trasporta il ferro attraverso la membrana cellulare dell'enterocita nella cellula.
Queste cellule di rivestimento intestinale possono quindi immagazzinare il ferro come ferritina, che viene ottenuto da Fe3 + legandosi all'apoferritina (nel qual caso il ferro lascerà il corpo quando la cellula muore e viene espulso dalle feci), o la cellula può rilasciarlo in il corpo tramite l'unico noto esportatore di ferro nei mammiferi, la ferroportina. Hephaestin, una ferroxidasi che può ossidare Fe2 + in Fe3 + e si trova principalmente nell'intestino tenue, aiuta la ferroportina a trasferire il ferro attraverso l'estremità basolaterale delle cellule dell'intestino. Al contrario, la ferroportina viene repressa dopo la traduzione dall'epcidina, un ormone peptidico di 25 aminoacidi. Il corpo regola i livelli di ferro regolando ciascuno di questi passaggi. Per esempio, gli enterociti sintetizzano più Dcytb, DMT1 e ferroportina in risposta all'anemia da carenza di ferro. L'assorbimento del ferro dalla dieta è aumentato in presenza di vitamina C e diminuito dall'eccesso di calcio, zinco o manganese.[9][senza fonte]
Il tasso di assorbimento del ferro del corpo umano sembra rispondere a una varietà di fattori interdipendenti, tra cui depositi di ferro totali, la misura in cui il midollo osseo sta producendo nuovi globuli rossi, la concentrazione di emoglobina nel sangue e il contenuto di ossigeno del sangue. Il corpo assorbe anche meno ferro durante i periodi di infiammazione, al fine di privare i batteri di ferro. Recenti scoperte dimostrano che la regolazione dell'epcidina di ferroportina è responsabile della sindrome da anemia di malattia cronica.
Riciclaggio e perdita del ferro
La maggior parte del ferro nel corpo viene accumulato e riciclato dal sistema reticoloendoteliale, che abbatte i globuli rossi invecchiati. In contrasto con l'assorbimento del ferro e il riciclaggio, non esiste un meccanismo di regolazione fisiologica per l'escrezione di ferro. Le persone perdono una piccola ma costante quantità dalla perdita di sangue gastrointestinale, dalla sudorazione e dallo spargimento delle cellule della pelle e del rivestimento mucoso del tratto gastrointestinale. La quantità totale di perdita per le persone sane nel mondo sviluppato ammonta a una media stimata di 1 al giorno per gli uomini e 1,5-2 mg al giorno per le donne con periodi mestruali regolari. Le persone con infezioni parassitarie gastrointestinali, più comunemente riscontrate nei paesi in via di sviluppo, spesso perdono di più. Coloro che non riescono a regolare abbastanza bene l'assorbimento ottengono disturbi da sovraccarico di ferro. In queste malattie, la tossicità del ferro inizia a travolgere la capacità del corpo di legarla e conservarla.[10][senza fonte]
Regolazione cellulare del Ferro
Intake di Ferro
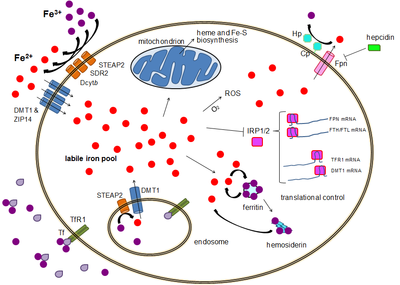
La maggior parte dei tipi di cellule assorbono il ferro principalmente attraverso l'endocitosi mediata dal recettore attraverso il recettore 1 della transferrina (TFR1), il recettore 2 della transferrina (TFR2) e il GAPDH. TFR1 ha un'affinità di 30 volte superiore per il ferro legato alla transferrina rispetto a TFR2 e quindi è il giocatore principale in questo processo.[11][12] L'enzima glicolitico multifarmico di grado superiore gliceraldeide-3-fosfato deidrogenasi (GAPDH) agisce anche come recettore della transferrina.[13][14] Il ferro ferrico legato alla transferrina è riconosciuto da questi recettori della transferrina, innescando un cambiamento conformazionale che causa l'endocitosi. Il ferro entra quindi nel citoplasma dall'endosoma attraverso l'importatore DMT1 dopo essere stato ridotto allo stato ferroso da una famiglia di STEAP reduttasi.[15]
In alternativa, il ferro può entrare nella cellula direttamente tramite importatori di cationi bivalenti di membrana plasmatica come DMT1 e ZIP14 (proteina 14 di tipo Zrt-Irt).[16] Ancora una volta, il ferro entra nel citoplasma nello stato ferroso dopo essere stato ridotto nello spazio extracellulare da una reduttasi come STEAP2, STEAP3 (negli eritrociti), Dcytb (negli enterociti) e SDR2.
Pool di ferro transitorio
Nel citoplasma, il ferro ferroso si trova in uno stato solubile, chelabile che costituisce il pool di ferro transitorio (~ 0,001 mM).[17] In questo pool si pensa che il ferro sia legato a composti a bassa massa come peptidi, carbossilati e fosfati, anche se alcuni potrebbero essere in una forma idratata libera (ioni di acqua). In alternativa, gli ioni di ferro potrebbero essere legati a proteine specializzate note come metallochaperoni.[18] Nello specifico, le proteine leganti poly-r (C) sembrano transitare dal trasferimento di ferro libero agli enzimi ferritinici (per la conservazione) e non-eme (da usare nella catalisi).[19] Il pool di ferro labili è potenzialmente tossico a causa della capacità del ferro di generare specie reattive dell'ossigeno. Il ferro da questo pool può essere assorbito dai mitocondri attraverso il mitoferrino per sintetizzare i gruppi Fe-S e i gruppi eme.
Deposito di Ferro
Il ferro può essere immagazzinato nella ferritina come ferro ferrico a causa dell'attività della ferroxidasi della catena pesante della ferritina.[20] La ferritina disfunzionale può accumularsi come emosiderina, che può essere problematica in caso di sovraccarico di ferro.[21] Il pool di ferro di stoccaggio della ferritina è molto più grande del pool di ferro labile, con una concentrazione compresa tra 0,7 mM e 3,6 mM.
Outake di Ferro
L'esportazione di ferro avviene in una varietà di tipi di cellule, inclusi neuroni, eritrociti, macrofagi ed enterociti. Questi ultimi due sono particolarmente importanti poiché i livelli di ferro sistemici dipendono da essi. Esiste solo un noto esportatore di ferro, la ferroportina.[22] Il trasporto di ferro ferroso fuori dalla cellula, generalmente aiutato da ceruloplasmina e / o efalina (principalmente negli enterociti), che ossidano il ferro al suo stato ferrico in modo che possa legare la ferritina nel mezzo extracellulare.L'epcidina causa l'internalizzazione della ferroportina, diminuendo l'esportazione di ferro. Inoltre, l'epcidina sembra sottoregolare sia il TFR1 che il DMT1 attraverso un meccanismo sconosciuto.[23] Un altro giocatore che assiste alla ferroportina nell'effettuare l'esportazione di ferro cellulare è GAPDH.[24] Un'isoforma di GAPDH post-traduzionale modificata viene reclutata sulla superficie di cellule caricate di ferro dove recluta apo-transferrina in stretta prossimità con ferroportina in modo da chelare rapidamente il ferro estruso.[25]
L'espressione dell'epcidina, che si verifica solo in alcuni tipi di cellule come gli epatociti, è strettamente controllata a livello trascrizionale e rappresenta il legame tra l'omeostasi del ferro cellulare e sistemico a causa del ruolo dell'epcidina come "gatekeeper" del rilascio di ferro dagli enterociti nel resto del corpo. Gli eritroblasti producono l'eritroferrone, un ormone che inibisce l'epcidina e quindi aumenta la disponibilità di ferro necessario per la sintesi dell'emoglobina.[26]
Controllo del trasporto del ferro cellulare
Sebbene esista un controllo a livello trascrizionale, la regolazione dei livelli di ferro cellulare viene infine controllata a livello traslazionale da proteine leganti l'elemento ferro-reattivo IRP1 e specialmente IRP2.[27] Quando i livelli di ferro sono bassi, queste proteine sono in grado di legarsi agli elementi sensibili al ferro (IRE). Gli IRE sono presenti nelle regioni non tradotte (UTR) dell'mRNA.
Sia la ferritina che la ferroportina contengono un IRE nei loro 5 'UTR, così che sotto la carenza di ferro la loro traduzione viene repressa dall'IRP2, impedendo la sintesi inutile delle proteine di stoccaggio e l'esportazione dannosa di ferro. Al contrario, TFR1 e alcune varianti DMT1 contengono 3 UTR IRE, che legano l'IRP2 sotto carenza di ferro, stabilizzando l'mRNA, che garantisce la sintesi degli importatori di ferro.
Patologia legata al ferro
Deficit di Ferro

- Aumento della domanda di ferro, che la dieta non può accogliere.
- Aumento della perdita di ferro (di solito attraverso la perdita di sangue).
- Carenza nutrizionale Ciò può derivare da una mancanza di ferro alimentare o dal consumo di alimenti che inibiscono l'assorbimento del ferro, inclusi calcio, fitati e tannini. Il tè nero impregnato a lungo ha alti tannini.
- Incapacità di assorbire il ferro: una causa comune di carenza di ferro è l'uso diffuso di farmaci che riducono l'acido, i più forti dei quali sono gli inibitori della pompa protonica (PPI) come l'omeprazolo.
- Danni al rivestimento intestinale. Esempi di cause di questo tipo di danno includono la chirurgia che coinvolge il duodeno, o malattie come il Crohn o il serpente celiaco che riducono drasticamente la superficie disponibile per l'assorbimento. Infiammazione che porta alla restrizione indotta da epcidina sul rilascio di ferro dagli enterociti (vedi sopra).
[senza fonte][senza fonte][senza fonte][senza fonte]
Sovraccarico di ferro
Il corpo è in grado di ridurre sostanzialmente la quantità di ferro che assorbe attraverso la mucosa. Non sembra in grado di interrompere completamente il processo di trasporto del ferro. Inoltre, in situazioni in cui l'eccesso di ferro danneggia la stessa parete intestinale (ad esempio, quando i bambini mangiano una grande quantità di compresse di ferro prodotte per consumo adulto), ancora più ferro può entrare nel sangue e causare una sindrome potenzialmente mortale di sovraccarico di ferro. Grandi quantità di ferro libero nella circolazione causeranno danni alle cellule critiche nel fegato, nel cuore e in altri organi metabolicamente attivi.
La tossicità del ferro si verifica quando la quantità di ferro circolante supera la quantità di transferrina disponibile per legarla, ma il corpo è in grado di regolare vigorosamente il suo assorbimento di ferro. Pertanto, la tossicità da ferro dovuta all'ingestione è solitamente il risultato di circostanze straordinarie come il consumo eccessivo di compresse di ferro[28][29]piuttosto che variazioni nella dieta. Il tipo di tossicità acuta da ingestione di ferro provoca gravi danni alla mucosa nel tratto gastrointestinale, tra gli altri problemi.
La tossicità cronica del ferro è solitamente il risultato di più sindromi da sovraccarico di ferro croniche associate a malattie genetiche, trasfusioni ripetute o altre cause. In tali casi le riserve di ferro di un adulto possono raggiungere 50 grammi (10 volte il ferro normale del corpo totale) o più. Esempi classici di sovraccarico genetico di ferro comprendono l'emocromatosi ereditaria (HH) e l'emocromatosi giovanile di malattia più grave (JH) causata da mutazioni nel gene RGMc del gene, un membro di una famiglia di molecole di guida repulsiva a tre geni,[30] (chiamato anche emoiuvelina (HJV) e HFE2), l'emoiuvelina o il gene HAMP che codifica un peptide regolatore di ferro (epcidina). I meccanismi esatti della maggior parte delle varie forme di emocromatosi adulta, che costituiscono la maggior parte dei disturbi genetici da sovraccarico di ferro, rimangono irrisolti. Così, mentre i ricercatori sono stati in grado di identificare le mutazioni genetiche che causano diverse varianti adulte dell'emocromatosi, ora devono rivolgere la loro attenzione alla normale funzione di questi geni mutati.
Fonti
- ^ vol. 342, DOI:10.1056/NEJM200004273421716, PMID 10787338, https://oadoi.org/10.1056/NEJM200004273421716. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 33, DOI:10.1016/s0891-5849(02)01006-7, https://oadoi.org/10.1016/s0891-5849(02)01006-7. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 341, DOI:10.1056/NEJM199912233412607, PMID 10607817, https://oadoi.org/10.1056/NEJM199912233412607. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 79, DOI:10.1128/aem.02202-12, PMID 23124235, https://oadoi.org/10.1128/aem.02202-12. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 186, DOI:10.1128/jb.186.18.5997-6002.2004, PMID 15342568, https://oadoi.org/10.1128/jb.186.18.5997-6002.2004. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 102, DOI:10.1182/blood-2003-03-0672, PMID 12663437, https://oadoi.org/10.1182/blood-2003-03-0672. Parametro
titolovuoto o mancante (aiuto) - ^ uptodate.com, http://www.uptodate.com/contents/regulation-of-iron-balance.
- ^ vol. 291, DOI:10.1126/science.1057206, PMID 11230685, https://oadoi.org/10.1126/science.1057206. Parametro
titolovuoto o mancante (aiuto) - ^ ohioline.osu.edu, http://ohioline.osu.edu/hyg-fact/5000/5559.html.
- ^ uptodate.com, http://www.uptodate.com/contents/iron-overload-syndromes-other-than-hereditary-hemochromatosis.
- ^ vol. 275, DOI:10.1074/jbc.M908846199, PMID 10748106, https://oadoi.org/10.1074/jbc.M908846199. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 275, DOI:10.1074/jbc.C000664200, PMID 11027676, https://oadoi.org/10.1074/jbc.C000664200. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 44, DOI:10.1016/j.biocel.2011.10.016, PMID 22062951, https://oadoi.org/10.1016/j.biocel.2011.10.016. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 1830, DOI:10.1016/j.bbagen.2013.03.019, PMID 23541988, https://oadoi.org/10.1016/j.bbagen.2013.03.019. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 142, DOI:10.1016/j.cell.2010.06.028, PMID 20603012, https://oadoi.org/10.1016/j.cell.2010.06.028. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 1853, DOI:10.1016/j.bbamcr.2015.01.021, PMID 25661197, http://www.sciencedirect.com/science/article/pii/S0167488915000361. Parametro
titolovuoto o mancante (aiuto) - ^ https://www.springer.com/gp/book/9781934115220. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 300, DOI:10.1126/science.1085049, PMID 12738850, https://oadoi.org/10.1126/science.1085049. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 5, DOI:10.3389/fphar.2014.00173, http://journal.frontiersin.org/article/10.3389/fphar.2014.00173/full. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 33, DOI:10.1016/s0891-5849(02)00842-0, PMID 12160928, https://oadoi.org/10.1016/s0891-5849(02)00842-0. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 13, DOI:10.1016/j.spen.2006.08.002, PMID 17101452, https://oadoi.org/10.1016/j.spen.2006.08.002. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 1, DOI:10.1016/j.cmet.2005.02.005, PMID 16054057, https://oadoi.org/10.1016/j.cmet.2005.02.005. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 59, DOI:10.1002/glia.21166, PMID 21438013, https://oadoi.org/10.1002/glia.21166. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 42, DOI:10.1042/BST20140220, PMID 25399609, https://oadoi.org/10.1042/BST20140220. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 127, DOI:10.1242/jcs.154005, PMID 25074810, https://oadoi.org/10.1242/jcs.154005. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 46, DOI:10.1038/ng.2996, PMID 24880340, https://oadoi.org/10.1038/ng.2996. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 28, DOI:10.1146/annurev.nutr.28.061807.155521, PMID 18489257, https://oadoi.org/10.1146/annurev.nutr.28.061807.155521. Parametro
titolovuoto o mancante (aiuto) - ^ Baker
- ^ ISBN 0-07-112457-8. Parametro
titolovuoto o mancante (aiuto) - ^ vol. 422, DOI:10.1042/BJ20090978, PMID 19698085, https://oadoi.org/10.1042/BJ20090978. Parametro
titolovuoto o mancante (aiuto)