Etilammina
| Etilammina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| etanammina | |
| Nomi alternativi | |
| amminoetano monoetilammina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C2H7N |
| Massa molecolare (u) | 45,08 |
| Aspetto | gas da incolore a giallastro dall'odore pungente |
| Numero CAS | |
| Numero EINECS | 200-834-7 |
| PubChem | 6341 |
| SMILES | CCN |
| Proprietà chimico-fisiche | |
| Densità (kg·m−3, in c.s.) | 2,162 |
| Solubilità in acqua | miscibile |
| Temperatura di fusione | -81 °C (192,15 K) |
| Temperatura di ebollizione | 16,6 °C (289,75 K) |
| Indicazioni di sicurezza | |
| Punto di fiamma | -37 °C (236,15 K) |
| Limiti di esplosione | 3,5-14 %V in aria |
| Temperatura di autoignizione | 385 °C (658,15 K) |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 220 - 319 - 335 |
| Consigli P | 210 - 261 - 305+351+338 [1] |
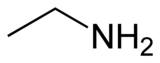
L'etilammina è un'ammina con formula CH3CH2NH2. In condizioni ambientali si presenta come un gas da incolore a giallastro e dall'odore pungente. È un composto miscibile in acqua e con proprietà debolmente basiche. Viene posta in commercio sotto forma di gas liquefatto o in soluzione acquosa. Trova utilizzo nell'industria chimica e nella sintesi organica.
Sintesi
[modifica | modifica wikitesto]L'etilammina viene prodotta su larga scala attraverso due processi. Più comunemente, etanolo e ammoniaca vengono fatti reagire in presenza di un ossido quale catalizzatore:
- CH3CH2OH + NH3 → CH3CH2NH2 + H2O
In questa reazione, oltre all'etilammina si ottengono anche dietilammina e trietilammina. In totale vengono prodotte industrialmente approssimativamente 80.000 tonnellate/anno di queste tre ammine.[2]
Un altro metodo di sintesi consiste nell'amminazione riduttiva dell'acetaldeide:
- CH3CHO + NH3 + H2 → CH3CH2NH2 + H2O
L'etilammina può essere preparata attraverso diversi altri modi meno economici. Etilene e ammoniaca reagiscono formando etilammina in presenza di sodio ammide o altro catalizzatore basico simile:[3]
- H2C=CH2 + NH3 → CH3CH2NH2
L'idrogenazione di acetonitrile, acetammide e nitroetano è un altro metodo che produce etilammina. Queste reazioni possono essere effettuate stechiometricamente con tetraidroalluminato di litio. Un'altra alternativa è la sintesi che utilizza la sostituzione nucleofila di un aloetano (come il cloroetano o il bromoetano) con ammoniaca, utilizzando una base forte come l'idrossido di potassio. Questa metodica produce una quantità significativa di sottoprodotti, incluse dietilammina e trietilammina:[4]
- CH3CH2Cl + NH3 + KOH → CH3CH2NH2 + KCl + H2O
Usi
[modifica | modifica wikitesto]L'etilammina trova utilizzo nella produzione di prodotti farmaceutici, coloranti e lacche, materie plastiche e solventi. È un precursore di molti erbicidi, tra cui l'atrazina e la simazina.
Note
[modifica | modifica wikitesto]- ^ Scheda IFA-GESTIS
- ^ Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke, “Amines, Aliphatic” Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.DOI: 10.1002/14356007.a02_001
- ^ Ulrich Steinbrenner, Frank Funke, Ralf Böhling, Method and device for producing ethylamine and butylamine Archiviato il 12 settembre 2012 in Archive.is.
- ^ Nucleophilic substitution, Chloroethane & Ammonia Archiviato il 28 maggio 2008 in Internet Archive., St Peter's School
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su etilammina
Wikimedia Commons contiene immagini o altri file su etilammina
Collegamenti esterni
[modifica | modifica wikitesto]- etilammina, su sapere.it, De Agostini.
| Controllo di autorità | LCCN (EN) sh85045432 · GND (DE) 4656739-2 · J9U (EN, HE) 987007557798305171 |
|---|