Effetto gauche
Il termine gauche si riferisce a quegli isomeri conformazionali (conformeri) in cui due gruppi vicinali sono separati da un angolo diedro di 60°. La IUPAC definisce gauche come sinonimo di allineamento sinclinale di gruppi vicinali.[1]
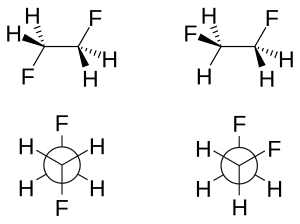
In stereochimica, le interazioni gauche impediscono la rotazione attorno al legame. Per esempio, ponendoci lungo il legame C2-C3 nella conformazione sfalsata del butano, ci sono due possibili energie potenziali relative. I due gruppi metilici possono essere in una relazione di antilegame o essere separati da un angolo diedro di 60°. Nella seconda conformazione, si dice che i due metili sono in una conformazione gauche, e l'energia potenziale relativa di ciascuna interazione gauche metile-metile è di 0.9 kilocalorie per mole (4 kJ/mol).
Effetto gauche[modifica | modifica wikitesto]
L'effetto gauche caratterizza ogni rotamero gauche che è più stabile del relativo antirotamero. La conformazione gauche del 1,2-difluoroetano (H2FCCFH2), per esempio, è più stabile di 1 kJ/mole (da 2.4 a 3.4 kJ/mole) in fase gassosa. Un altro esempio è il 1,2-dimetossietano.

Ci sono principalmente due spiegazioni per l'effetto Gauche: l'iperconiugazione e i legami piegati. Nel modello dell'iperconiugazione, l'interazione di elettroni tra l'orbitale di legame σ di C–H e l'orbitale di antilegame σ* di C–F è considerata la causa della stabilità dell'isomero gauche. A causa dell'elevata elettronegatività del fluoro, l'orbitale σ di C–H è un miglior elettrondonatore dell'orbitale σ di C–F, mentre l'orbitale σ* di C–F è un miglior accettore di elettroni rispetto all'orbitale molecolare σ* di C–H. Solo la conformazione gauche permette la sovrapposizione tra il miglior donatore e il miglior accettore di elettroni
La chiave nella spiegazione dell'effetto gauche attraverso il modello dei legami piegati nel difluoroetano è l'aumento di carattere p negli orbitali di entrambi i legami C–F a causa della grande elettronegatività del fluoro. Il risultato di ciò è che la densità elettronica si accumula attorno al legame C-C centrale. La ridotta sovrapposizione orbitalica che ne risulta può essere in parte compensata quando viene assunta una conformazione gauche grazie alla formazione di un legame piegato. Di questi due modelli l'iperconiugazione è generalmente considerata la causa principale dell'effetto gauche nel difluoroetano.[2][3]
La geometria molecolare di entrambi i rotameri può essere ottenuta sperimentalmente con una spettroscopia infrarossa perfezionata con studi in silico.[4] In accordo con il modello descritto sopra, la lunghezza del legame carbonio-carbonio è maggiore per l'antirotamero (151.4 pm contro 150 pm). La repulsione sterica tra gli atomi di fluoro nei rotameri gauche aumenta l'angolo di legame CCF (di 3.2°) e aumenta l'angolo diedro (dai 60° standard a 71°).
Nel 1,2-difluorodifeniletano (in cui, rispetto al difluoroetano, due idrogeni sono stati sostituiti da due fenili) si è scoperto (con la cristallografia a raggi x e dalle costanti di accoppiamento NMR) che gli isomeri (S,S) ed (R,R) hanno i due gruppi fenilici e i due atomi di fluoro in posizione anti e una conformazione gauche è stata scoperta per entrambi i gruppi degli isomeri (S,R) e (R,S).[5] In accordo con i risultati in silico questa conformazione è più stabile di 0.21 kcal/mol (880 J/mol).
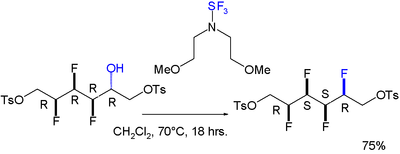
Un effetto gauche è stato anche individuato per una molecola su cui vengono effettuate 4 sostituzioni in syn con fluoro, l'ultima delle quali grazie all'agente bis(2-methoxyethyl)aminosulfur trifluoride:[6]
L'effetto gauche è molto sensibile al cosiddetto effetto solvente a causa della grande differenza di elettronegatività tra i due conformeri. Per esempio, 2,3-dinitro-2,3-dimetilbutano, che allo stato solido esiste solo nella conformazione di gauche, in benzene preferisce la conformazione di gauche con un rapporto 79:21, mentre in carbon tetrachloride preferisce il conformero anti con un rapporto 58:42.[7] Un altro caso è il trans-1,2 difluorocicloesano, che, in solventi polari, preferisce la conformazione con i due sostituenti equatoriali.[3]
Un effetto correlato è l'isomeria cis trans.
Note[modifica | modifica wikitesto]
- ^ gauche, su goldbook.iupac.org, IUPAC Gold Book. URL consultato il 2 febbraio 2018.
- ^ Goodman, L.; Gu, H.; Pophristic, V. Gauche Effect in 1,2-Difluoroethane. Hyperconjugation, Bent Bonds, Steric Repulsion. J. Phys. Chem. A. 2005, 109, 1223–1229. DOI: 10.1021/jp046290d
- ^ a b David O'Hagan. Understanding organofluorine chemistry. An introduction to the C–F bond. Chem. Soc. Rev. 2008 DOI: 10.1039/b711844a
- ^ Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane Norman C. Craig, Anthony Chen, Ki Hwan Suh, Stefan Klee, Georg C. Mellau, Brenda P. Winnewisser, and Manfred Winnewisser J. Am. Chem. Soc.; 1997; 119(20) pp 4789–4790; (Communication) DOI: 10.1021/ja963819e
- ^ The vicinal difluoro motif: The synthesis and conformation of erythro- and threo- diastereoisomers of 1,2-difluorodiphenylethanes, 2,3-difluorosuccinic acids and their derivatives O'Hagan D, Rzepa H, Schuler M, Slawin A, in Beilstein Journal of Organic Chemistry, 2006 2:19 ( 2 October 2006 ) DOI: 10.1186/1860-5397-2-19
- ^ Enantioselective Synthesis of an All-syn Four Vicinal Fluorine Motif Luke Hunter, David O'Hagan, and Alexandra M. Z. Slawin, in J. Am. Chem. Soc., 2006; 128(51) pp 16422–16423; (Communication) DOI: 10.1021/ja066188p
- ^ Smith, Michael. B.; March, J. March's Advanced Organic Chemistry, 5th edition. Wiley, 2001. ISBN 0-471-58589-0
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Effetto gauche
Wikimedia Commons contiene immagini o altri file su Effetto gauche